摘要:30. 某同学想通过下图装置实验.探究SO2与Na2O2反应的产物. Ⅰ.装置B的作用 . 装置D的作用 . Ⅱ.如何检验反应中是否有O2生成 . Ⅲ.对C中固体产物提出如下假设: 假设1:只有Na2SO3 假设2:只有Na2SO4 假设3: . (1)假设2的反应方程式为 . (2)若Na2O2反应完全.为确定C中固体产物的成分.甲设计如下实验: 得出结论:产物是Na2SO4. 该方案是否合理 .理由是 . (3)设计实验验证假设3:取少量C中固体产物于试管中.加入适量的蒸馏水溶解. .则假设3成立.
网址:http://m.1010jiajiao.com/timu3_id_416088[举报]
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.

Ⅰ.装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为________.
Ⅱ.如何检验反应中是否有O2生成________.
Ⅲ.装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以________.
Ⅳ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:________.
(1)假设1的反应方程式:2SO2+2Na2O2=________.
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选实验试剂帮助他完成该探究过程,并将答案写在相应位置.
限选实验试剂:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1 mol/L HNO3溶液、4 mol/L盐酸.

某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.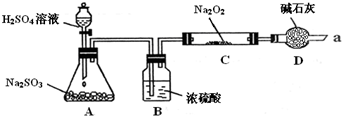
Ⅰ.装置D的作用
Ⅱ.如何检验反应中是否有O2生成
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
(1)装置C中,假设2的反应方程式为
(2)乙同针对以上两个假设,提出了两个实验方案方案
①在Na2O2反应完全后,为进行如上图实验:
C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3得出结论:产物是Na2SO4.该方案是否合理
方案②在反应进行一段时间后,取少量C中固体放入BaCl2溶液中,充分反应后再加入足量稀盐酸,如果溶液中出现白色沉淀,可得出结论,产物是Na2SO4,假设2成立,此方案是否合理
查看习题详情和答案>>

Ⅰ.装置D的作用
吸收二氧化硫尾气,防止污染
吸收二氧化硫尾气,防止污染
.Ⅱ.如何检验反应中是否有O2生成
将带火星的木条靠近管口a,若木条复燃,说明有氧气生成
将带火星的木条靠近管口a,若木条复燃,说明有氧气生成
.Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
(1)装置C中,假设2的反应方程式为
Na2O2+SO2=Na2SO4
Na2O2+SO2=Na2SO4
.(2)乙同针对以上两个假设,提出了两个实验方案方案
①在Na2O2反应完全后,为进行如上图实验:
C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3得出结论:产物是Na2SO4.该方案是否合理
否
否
(填“是”或“否”),理由是稀硝酸能将生成的BaSO3氧化为BaSO4而使沉淀不溶于稀硝酸
稀硝酸能将生成的BaSO3氧化为BaSO4而使沉淀不溶于稀硝酸
.方案②在反应进行一段时间后,取少量C中固体放入BaCl2溶液中,充分反应后再加入足量稀盐酸,如果溶液中出现白色沉淀,可得出结论,产物是Na2SO4,假设2成立,此方案是否合理
否
否
(填”是”或”否”)理由是若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀.
若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀.
.某同学想通过下图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
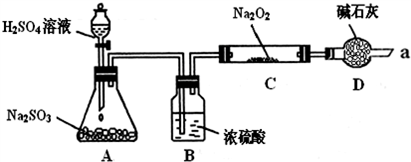
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示):
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:
Ⅱ.对C中固体产物提出如下假设:
假设1:只有Na2SO3假设2:只有Na2SO4假设3:
(1)若假设2成立,写出所发生反应的化学方程式
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.该方案是否合理?答:
(3)设计实验方案验证假设3,进行实验.在下表中写出实验步骤以及预期现象和结论.
限选试剂:1mol?L-1 BaCl2溶液、1mol?L-1 Ba(NO3)2溶液、1mol?L-1稀盐酸、1mol?L-1稀硝酸
查看习题详情和答案>>

Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示):
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
;装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应
.Ⅱ.对C中固体产物提出如下假设:
假设1:只有Na2SO3假设2:只有Na2SO4假设3:
含有Na2SO3和Na2SO4
含有Na2SO3和Na2SO4
.(1)若假设2成立,写出所发生反应的化学方程式
Na2O2+SO2=Na2SO4
Na2O2+SO2=Na2SO4
.(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.该方案是否合理?答:
否
否
(填“是”或“否”).(3)设计实验方案验证假设3,进行实验.在下表中写出实验步骤以及预期现象和结论.
限选试剂:1mol?L-1 BaCl2溶液、1mol?L-1 Ba(NO3)2溶液、1mol?L-1稀盐酸、1mol?L-1稀硝酸
| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ② | |
| ③ |
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
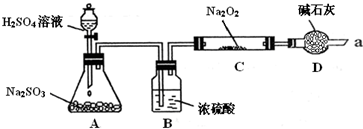
Ⅰ如何检验反应中是否有O2生成 .
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以 .
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3: .
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管
查看习题详情和答案>>

Ⅰ如何检验反应中是否有O2生成
Ⅱ装置D除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以
Ⅲ对C中固体产物提出如下假设:
假设1:只有Na2SO3 假设2:只有Na2SO4 假设3:
(1)假设1的反应方程式:2SO2+2Na2O2=
(2)若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置.限选试剂和仪器:酸性KMnO4溶液、Ba(NO3)2溶液、BaCl2溶液、1mol/L HNO3溶液、4mol/L盐酸、试管、胶头滴管
| 实验操作 | 预期现象 | 结 论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中 | 固体完全溶解,得到无色透明溶液 | / |
| 步骤二:取试管A,向溶液中加入 |
假设1 或假设3成立;若没有该现象则假设2成立. | |
| 步骤三:取试管B,向其中先加入 再加入 |
产生 再加入试剂看到产生白色沉淀. |
假设3成立.若无白色沉淀产生则假设1成立. |