摘要:20. 设生成8 L SO2.则原氧气为11×1.2=13.2(L).反应后混合气体积为10.2 L. SO2%=8/10.2=78.4% (2)①b=0.5a+8 ②b=11.b=10.7 即:32/3 21A. (1)[Ar]3d104s24p5 (2) BrI> ICl> Cl2 (3)RbCl (4)V形 (5)HF分子间形成氢键 (6)①②③ B (1)倾析法过滤 玻璃棒.烧杯 (2)用玻璃棒蘸取少量待测液将其点在洁净干燥表面皿中的pH试纸上.再与标准比色卡进行对比 (3)
网址:http://m.1010jiajiao.com/timu3_id_416053[举报]
甲同学釆用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体
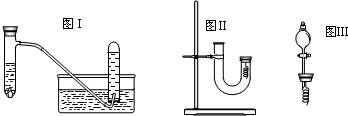
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
(5)从环保的角度看,丙同学的实验存在的缺陷是
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
mol/L
mol/L
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
查看习题详情和答案>>

(1)写出试管内溶液中发生反应的化学方程式
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
(2)在实验过程中观察到试管内的溶液呈
绿
绿
色;收集气体的试管内的气体呈无
无
色(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
有关化学方程式为:
2NO+O2=2NO2
2NO+O2=2NO2
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
将氮氧化合物放入空气中会污染环境
将氮氧化合物放入空气中会污染环境
.(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
3
3
步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①打开分液漏斗上部的塞子
打开分液漏斗上部的塞子
②慢慢打开分液漏斗的活塞
慢慢打开分液漏斗的活塞
③待液面与胶塞接触时立即关闭活塞
待液面与胶塞接触时立即关闭活塞
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
3NO2+H2O=2 HNO3+NO
3NO2+H2O=2 HNO3+NO
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
10.86mol﹒L-1
10.86mol﹒L-1
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
5.71
5.71
升.(保留两位小数);解题过程:设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
.3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
(1)血糖是指血液中的葡萄糖(C6H12O6).下列说法不正确的是 (填序号);
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法.试写出该反应的化学方程式: ,该反应的反应类型是 ;
(3)今有有机物A、B,分子式不同,均可能含C、H、O元素中的两种或三种.如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变.若A是甲烷,则符合上述条件的有机物B中分子量最小的是 (写化学式).并写出分子量最小的含有-CH3(甲基)的B的两种同分异构体的结构简式 、 ;
(4)分析下表所列数据,可以得出的结论是(写出2条即可) .
查看习题详情和答案>>
(1)血糖是指血液中的葡萄糖(C6H12O6).下列说法不正确的是
A.糖尿病人尿糖偏高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
B.葡萄糖属于碳水化合物,分子可表示为 C6(H2O)6,则每个葡萄糖分子中含6个H2O
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)含糖类丰富的农产品通过发酵法可以制取乙醇,但随着石油化工的发展,工业上主要是以乙烯为原料,在加热、加压和有催化剂存在的条件下跟水反应生成乙醇,这种方法叫做乙烯水化法.试写出该反应的化学方程式:
(3)今有有机物A、B,分子式不同,均可能含C、H、O元素中的两种或三种.如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变.若A是甲烷,则符合上述条件的有机物B中分子量最小的是
(4)分析下表所列数据,可以得出的结论是(写出2条即可)
| 烷 基 | 氟化物 | 氯化物 | 溴化物 | 碘化物 |
| 沸点℃ | 沸点℃ | 沸点℃ | 沸点℃ | |
| CH3- | -78.4 | -24.2 | 3.6 | 42.4 |
| CH3-CH2- | -37.7 | 12.3 | 38.40 | 72.3 |
| CH3-CH2-CH2- | 2.5 | 46.60 | 71.0 | 102.4 |
| (CH3)2-CH- | -9.4 | 35.7 | 59.48 | 89.14 |
| CH3-CH2-CH2-CH2- | 32.5 | 78.44 | 101.6 | 130.5 |
| (CH3)2-CH CH2- | 16.0 | 68.7 | 91.7 | 120.4 |
| (CH3)3C- | 12.1 | 52 | 73.25 | 120.8 |
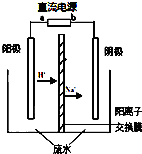 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O→CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O→CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH--4e-═O2↑+2H2O②
阴极:①
(3)电解过程中,阴极区Na2SO4的物质的量
(4)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
(5)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m3乙醛的含量为3000mg/L的废水,可得到乙醇
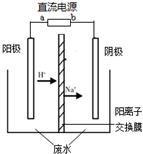 (2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
CH4
CH4
(填化学式)气体.(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH--4e-═O2↑+2H2O
②
CH3CHO-2e-+H2O═CH3COOH+2H+
CH3CHO-2e-+H2O═CH3COOH+2H+
阴极:①
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
4H++4e-═2H2↑或4H2O+4e-═2H2↑+4OH-
②CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量
不变
不变
(填“增大”、“减小”或“不变”).(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同.下列关于阳极区溶液中各微粒浓度关系的说法正确的是
abd
abd
(填字母序号).a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
蒸馏
蒸馏
.(6)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m3乙醛的含量为3000mg/L的废水,可得到乙醇
1.9
1.9
kg(计算结果保留小数点后1位).(12分) 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO
+ H2O CH3CH2OH
+ CH3COOH
CH3CH2OH
+ CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,
模拟乙醛废水的处理过程,其装置示意图如右图所示。
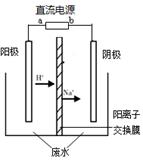
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH- - 4e- == O2↑+ 2H2O
②
阴极:①
② CH3CHO + 2e- + 2H2O == CH3CH2OH + 2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(5)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3000 mg/L的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
查看习题详情和答案>>