摘要:定性中有定量.如“由水电离出的H+或OH-浓度为1×10-amol/L的溶液中.-- 等. 典型例题 例1.在pH=0的无色透明溶液中.因发生氧化还原反应而不能大量共存的离子组是 A.Na+.K+.MnO4-.Cl- B.Cl-.S2O32-.K+.Na+ C.Na+.Cl-.CH3COO-.K+ D.K+.I-.Na+.ClO- 例2.(1)向NaHSO4溶液中.逐滴加入Ba(OH)2溶液至中性.写出发生反应的离子方程式: .在以上中性溶液中继续滴加Ba(OH)2溶液.写出此步反应的离子方程式: . 2溶液中.逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止.写出反应的离子方程式: .在以上溶液中.继续加NaHSO4溶液.写出此步反应的离子方程式: . 2溶液中.逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀.其反应的离子方程式是: .在上述溶液中.继续滴加明矾溶液.写出此步反应的离子方程式: . 课堂练习
网址:http://m.1010jiajiao.com/timu3_id_41586[举报]
现有中学化学常见的A、B、C、D、E、F、G、H等八种物质,在一定条件下可以发生如图1-3-19所示的转化。(②④⑤反应只写出其中一种生成物,另外一种生成物没有写出)。

图1-3-19
其中A和G的摩尔质量相等,且A为含非极性键的离子化合物;B在常温下是液态化合物;D是双原子气体单质;H是常见金属。
(1)A的电子式:___________。
(2)H和C溶液反应的化学方程式为___________。其中氧化剂是___________。
(3)用离子方程式表示E的水溶液呈碱性的原因___________。
(4)在E溶液转化为G的⑤反应中,最好选用下列哪种试剂___________,其理由是_____________________________________________________________________。
A.稀盐酸 B.CO2 C.氨水 D.NaOH溶液 E.H2O
(5)若H与金属镁用导线连接后插入C溶液中可以构成原电池,写出负极的电极反应式:___________。
查看习题详情和答案>>a,b,c,d,e,f,g,h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:

其中b离子半径大于e离子半径;d由4原子构成;c与f可形成2个g分子,d与h在一定条件下可相互转化,试写出:
(1)a微粒原子核外结构示意图________.
(2)b与e相应元素最高价氧化物对应水化物的碱性强弱为:________>________(写化学式).
(3)大量c微粒和大量h微粒共热生成d微粒的离子方程式________.
查看习题详情和答案>>如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
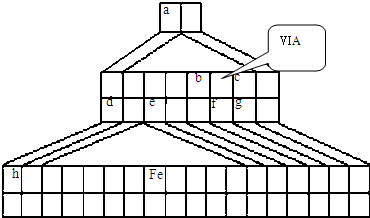
(1)如图中将铁元素在周期表中的位置是
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
(4)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是
第4周期第Ⅷ族
第4周期第Ⅷ族
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
促进
促进
(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为NH4++H2O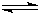 NH3?H2O+H+
NH3?H2O+H+
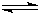 NH3?H2O+H+
NH3?H2O+H+NH4++H2O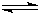 NH3?H2O+H+
NH3?H2O+H+
.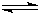 NH3?H2O+H+
NH3?H2O+H+(4)下列叙述正确的是
A、D、E
A、D、E
.A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
.如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是______
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______.
(4)下列叙述正确的是______.
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______.
查看习题详情和答案>>