摘要:5.在含有Fe.Fe.A1.NH的稀溶液中.加入足量的固体并微热.充分反应后.再加入过量的稀盐酸.完全反应后.离子数目没有明显变化的是 A.Fe B. Fe C.NH D.Al
网址:http://m.1010jiajiao.com/timu3_id_415609[举报]
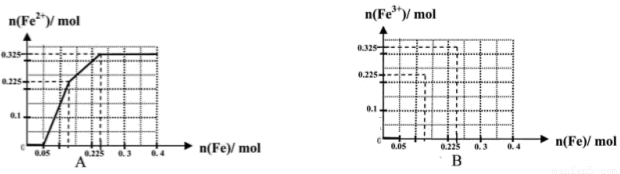
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
A.酸性KMnO4溶液??? B.含有盐酸的KSCN溶液??? C.碘水??? D.次氯酸钠溶液
(二)(5分)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
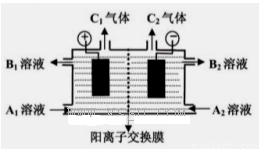
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式???????????????????????????????? .
(3)请简述阴极室能流出NaOH的浓溶液的原因????????????????????????? .
查看习题详情和答案>>
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种.
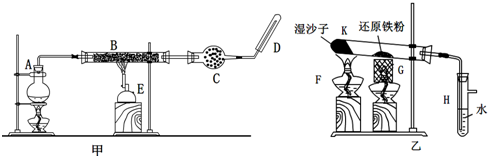
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性: .
(2)乙装置中湿沙子的作用是: .
(3)B处发生反应的化学方程式: .
(4)对比甲、乙两装置的B和K,B的优点是: .
(5)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出.若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可) .
(6)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化.经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe.他的理由是: .
查看习题详情和答案>>

已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性:
(2)乙装置中湿沙子的作用是:
(3)B处发生反应的化学方程式:
(4)对比甲、乙两装置的B和K,B的优点是:
(5)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出.若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)
(6)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化.经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe.他的理由是:
现有下列三个氧化还原反应:
Fe+CuCl2=FeCl2+Cu
2FeCl3+Fe=3FeCl2
2FeCl3+Cu=2FeCl2+CuCl2
在含有Fe3+、Fe2+、Cu2+的溶液中
(1)加入过量铁粉,反应后溶液中有
(2)加入过量铜粉,反应后溶液中有
查看习题详情和答案>>
Fe+CuCl2=FeCl2+Cu
2FeCl3+Fe=3FeCl2
2FeCl3+Cu=2FeCl2+CuCl2
在含有Fe3+、Fe2+、Cu2+的溶液中
(1)加入过量铁粉,反应后溶液中有
Fe2+
Fe2+
离子,没有Cu2+、Fe3+
Cu2+、Fe3+
离子;(2)加入过量铜粉,反应后溶液中有
Cu2+、Fe2+
Cu2+、Fe2+
离子,没有Fe3+
Fe3+
离子.某混合物粉末可能含有Al、Fe、FeO、Al2O3,某研究小组在实验室积极探究其组成.
(1)研究小组首先排除了含有单质Al的可能性,加入的试剂是
A.硫酸 B.盐酸 C.氨水 D.氢氧化钠溶液
证明不含单质铝的现象是
(2)该混合物的组成基本确定为Fe、FeO、Al2O3.请以上述粉末为样品,验证其组成.限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/L盐酸、3% H2O2、3mol/LCuSO4、蒸馏水.
根据你设计的实验方案,在答题卡上按下表的格式写出空白部分的实验操作、预期现象和结论.
查看习题详情和答案>>
(1)研究小组首先排除了含有单质Al的可能性,加入的试剂是
D
D
(填序号)A.硫酸 B.盐酸 C.氨水 D.氢氧化钠溶液
证明不含单质铝的现象是
无气泡冒出
无气泡冒出
.(2)该混合物的组成基本确定为Fe、FeO、Al2O3.请以上述粉末为样品,验证其组成.限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/L盐酸、3% H2O2、3mol/LCuSO4、蒸馏水.
根据你设计的实验方案,在答题卡上按下表的格式写出空白部分的实验操作、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤. | 粉末减少,说明粉末可能含有Al2O3 |
| 步骤2:取少量步骤1的滤液于试管中,逐滴滴加3mol/L盐酸至过量. | 有白色沉淀产生然后沉淀又溶解 有白色沉淀产生然后沉淀又溶解 ,说明粉末中含有Al2O3. |
| 步骤3:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤. | 有红色固体生成,说明粉末中含有 Fe Fe . |
| 步骤4: 将步骤3的滤渣转移到烧杯C中, 加入足量3mol/L盐酸,静置,取上层清液, 滴加适量的双氧水,充分振荡后滴加KSCN 溶液. 将步骤3的滤渣转移到烧杯C中, 加入足量3mol/L盐酸,静置,取上层清液, 滴加适量的双氧水,充分振荡后滴加KSCN 溶液. |
固体部分溶解,溶液变血红色,说明粉 末中含有FeO 固体部分溶解,溶液变血红色,说明粉 末中含有FeO |