题目内容
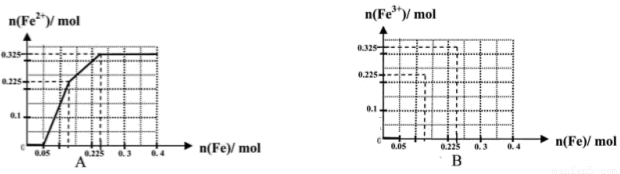
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
A.酸性KMnO4溶液??? B.含有盐酸的KSCN溶液??? C.碘水??? D.次氯酸钠溶液
(二)(5分)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
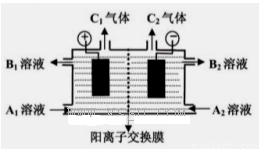
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式???????????????????????????????? .
(3)请简述阴极室能流出NaOH的浓溶液的原因????????????????????????? .
(一)(1)Cu2++Fe= Cu+Fe2+
(2) Fe+4H++NO-3=NO↑+2H2O+ Fe3+
(3)
(4)B
(二)(第一空1分,后两2空2分)
(1)H2
(2)4OH--4e-=O2↑+2H2O
(3)在电解的过程中,Na+被吸引移向阴极室,c(Na+)会增加;H+逐渐被消耗,又OH-受阳离子交换膜的阻碍不能移向阳极室,c(OH-)也增加,因此阴极室流出氢氧化钠的浓溶液。
【解析】
试题分析:分析题意,根据氧化还原反应的先后规律,得出溶液中与铁反应的离子的先后顺序及物质的量分别是n(H+)=0.2mol,n(NO3-)=0.2mol,n(Fe3+)=0.1mol,n(Cu2+)=0.1mol,Fe与H+ NO3-反应的离子方程式为Fe+4 H++ NO3-= Fe3++NO↑+2H2O,计算可知NO3-过量,按H+计算,此时消耗Fe0.05mol,生成Fe3+0.05mol,溶液中共有n(Fe3+)=0.15mol,Fe3+消耗Fe0.075mol, Cu2+消耗Fe0.1mol。
(1) 图中n(Fe)从0.125mol-0.225 mol段为Cu2+与Fe的反应,离子方程式为Fe+ Cu2+ =Cu+Fe2+
(2)图中n(Fe)从0-0.05 mol段为Fe与H+ NO3-反应,离子方程式为Fe+4 H++ NO3-= Fe3++NO↑+2H2O
(3)溶液中n(Fe3+)与加入n(Fe)的变化关系0~0.05mol时n(Fe3+)由0.1mol增加到0.15mol,然后从0.05~0.125mol n(Fe3+)减为0,如图

(4)反应进行到最后,溶液为硝酸亚铁的溶液,为证明该溶液中有NO3-存在,可向其中加入酸使溶液中存在硝酸,硝酸将亚铁离子氧化后用KSCN溶液检验,若溶液变红,证明有NO3-存在,所以答案选B。
(二)(1)C2极为电解槽阴极,阳离子放电,所以H+放电成为H2
(2)阳极是阴离子放电,根据溶液中的离子的放电顺序,所以是氢氧根离子放电,电极反应方程式为4OH--4e-=O2↑+2H2O
(3)在电解过程中,阳离子移向阴极,导致c(Na+)会增加;H+逐渐被消耗,又OH-受阳离子交换膜的阻碍不能移向阳极室,c(OH-)也增加,因此阴极室流出氢氧化钠的浓溶液。
考点:考查氧化还原反应的先后规律的应用,电解时离子的放电顺序


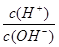 =1012。
=1012。
 。
。