摘要:等体积等浓度的KOH溶液和HAc溶液混和后.混和液中有关离子的浓度应满足下列关系的是---------------------------------( ) A.c(Ac-) >c(K+)>c(OH-)>c(H+) B.c(K+)>c(Ac-)>c(H+)>c(OH-) C.c(K+)=c(Ac-)>c(OH-)>c(H+) D.c(K+)+c(H+) =c(OH-)+c(Ac-)
网址:http://m.1010jiajiao.com/timu3_id_41428[举报]
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,在自然界主要以钨(+6价)酸盐的形式存在.有开采价值的钨矿石之一黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4和MnWO4,钨酸(H2WO4)酸性很弱,难溶于水.碳和金属钨在高温下会反应生成碳化钨.
黑钨矿传统冶炼工艺的第一阶段是碱熔法:
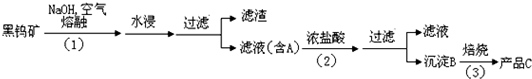
(1)黑钨矿浸入NaOH熔融液过程需通入大量空气,目的是为了使铁和锰转化为氧化物,其中一种红棕色的氧化物化学式为 ;
(2)①已知A的主要成分为Na2WO4,请写出Na2WO4与浓盐酸反应的离子方程式 ;
②上述流程中B、C都是钨的化合物,则步骤(3)中B→C转化属于 ;(填四种基本反应类型之一)
(3)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨(WO3)还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂.写出用碳还原氧化钨制取金属钨的化学方程式: ;为了获得可以拉制灯丝的高纯度金属钨,为什么不宜用碳而必须用氢气作还原剂? .
(4)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为 mol/L(精确到小数点后一位),所以实际生产过程 (填“能”或“不能”)通过加入FeCl2溶液的方法实现上述转化.(溶液混合体积变化可忽略)
查看习题详情和答案>>
黑钨矿传统冶炼工艺的第一阶段是碱熔法:

(1)黑钨矿浸入NaOH熔融液过程需通入大量空气,目的是为了使铁和锰转化为氧化物,其中一种红棕色的氧化物化学式为
(2)①已知A的主要成分为Na2WO4,请写出Na2WO4与浓盐酸反应的离子方程式
②上述流程中B、C都是钨的化合物,则步骤(3)中B→C转化属于
(3)钨冶炼工艺的第二阶段则是用碳、氢气等还原剂把氧化钨(WO3)还原为金属钨.对钨的纯度要求不高时,可用碳作还原剂.写出用碳还原氧化钨制取金属钨的化学方程式:
(4)常温下,黑钨矿中FeWO4和MnWO4的溶度积常数分别为:Ksp(FeWO4)=2.5×10-12;Ksp(MnWO4)=7.5×10-16;欲将体积为1L含MnWO4物质的量为0.6mol悬浊液全部转化为FeWO4悬浊液,理论上可往MnWO4悬浊液加入等体积一定浓度的FeCl2溶液完成上述转化;请计算所加入FeCl2溶液浓度为
(2010?辽宁二模)A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:
、Na+、H+,阴离子:Cl-、OH-、
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:

(1)根据图1的PH变化关系写出化学式:A
(2)B与过量的D反应生成E,写出该反应的离子方程式
(3)E的溶液显
(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积
(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为
查看习题详情和答案>>
| NH | + 4 |
| C2O | 2- 4 |

(1)根据图1的PH变化关系写出化学式:A
NH3?H2O
NH3?H2O
,CHCl
HCl
.(2)B与过量的D反应生成E,写出该反应的离子方程式
H2C2O4+OH-=HC2O4-+H2O
H2C2O4+OH-=HC2O4-+H2O
.(3)E的溶液显
酸
酸
(填“中性”、“酸性”或“碱性”),其原因是HC2O4-的电离程度大于水解程度
HC2O4-的电离程度大于水解程度
.(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积
>
>
10Ml(填“=”、“>”或“<”).H点离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+)
.(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为
3.2×10-5mol/L
3.2×10-5mol/L
.下列叙述的实验能达到预期目的的是:
|
|
实验内容 |
实验目的 |
|
A |
在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀 |
说明Ksp(AgCl)>Ksp(AgI) |
|
B |
分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液 |
研究反应物浓度对化学反应速率的影响 |
|
C |
向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液 |
检验SO42-存在 |
|
D |
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液 |
制备Fe(OH)3胶体 |
查看习题详情和答案>>
在两支试管中加入等体积同浓度的硫酸铜溶液, 再分别加入少量等质量的锌粒和锌粉,振荡,观察现象。试回答:
(1)试管中溶液颜色有何变化?___________________________;
(2)两支试管中的现象有何不同?_____________。
(3)用简要文字和有关离子方程式解释上述现象。
____________________________________ 。
查看习题详情和答案>>
A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子: 、Na+、H+,阴离子:Cl-、OH-、
、Na+、H+,阴离子:Cl-、OH-、 ),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:

(1)根据图1的PH变化关系写出化学式:A______,C______.
(2)B与过量的D反应生成E,写出该反应的离子方程式______.
(3)E的溶液显______(填“中性”、“酸性”或“碱性”),其原因是______.
(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积______10Ml(填“=”、“>”或“<”).H点离子浓度由大到小的顺序是______.
(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为______.
查看习题详情和答案>>
 、Na+、H+,阴离子:Cl-、OH-、
、Na+、H+,阴离子:Cl-、OH-、 ),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
(1)根据图1的PH变化关系写出化学式:A______,C______.
(2)B与过量的D反应生成E,写出该反应的离子方程式______.
(3)E的溶液显______(填“中性”、“酸性”或“碱性”),其原因是______.
(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积______10Ml(填“=”、“>”或“<”).H点离子浓度由大到小的顺序是______.
(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为______.
查看习题详情和答案>>