网址:http://m.1010jiajiao.com/timu3_id_41282[举报]
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡
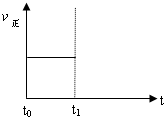
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 0.6 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
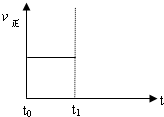
(3)上述反应在t时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
 查看习题详情和答案>>
查看习题详情和答案>>
(12分)绿色化学是当今社会人们提出的一个新概念,它可以公开为环境友好化学。它的核心内涵是在反应过程中和化工生产中,尽量减少或彻底消除使用和产生有害物质。这就是说,绿色化学的着眼点是使污染消灭在生产的源头,从根本上消除污染。1995年,美用总统克林顿首次设立“总统绿色化学挑战奖”,目的是鼓励、促进化学家们设计、改进化学产品和化工生产过程,使其对环境更加友好,企业经济效益得到更大的提高。为此,美国斯坦福大学Barry Trost教授提出了绿色化学下的原子经济的概念。最理想的原子经济是全部反应物的原子嵌入期望的最终产物中,不产生任何废弃物,这时的原子经济百分数便是100%。原子经济百分数的计算公式为:
![]()
例如:Claisen分子重排反应:
反应过程中只是改变了分子内部部分原子的连接方式,所有的反应物的原子全部并入最终产物中,所以这是一个100%的原子经济反应。
根据上述材料回答下列有关问题。
1.下面叙述错误的是_________(填编号,下同)。
①绿色化学和环境化学都是研究环境保护和治理的
②绿色化学不是被动的治理环境,而是主动地防止环境污染
③绿色化学保护了环境,而且也能给有关企业带来巨大的经济利益
2.硝酸工业的尾气中主要含NO、NO2气体。下列关于它们的危害的叙述中,正确的是_______________。①形成酸雨 ②破坏臭氧层 ③NO能刺激呼吸道 ④NO2能跟血红蛋白作用生成二氧化氮血红蛋白而引起中毒 ⑤NO、NO2在空气中形成褐色或黄色的毒性很大的烟雾。
工厂里常采用NaOH溶液吸收NO、NO2,使其转化为化工产品NaNO2,请写出其化学反应方程式
这一处理方法是否符合绿色化学概念__________(填“是”或“不是”)。其原子经济百分数为 。
3.有人采用下面两种方法制取Cu (NO3)2。
①方法一:2Cu+O2![]() 2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O
2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O
②方法二;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
其中符合绿色化学概念的方法是________________。
4.有人将3中反应②产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式:
解释最后的气体压强略小于1.01×107 Pa的2/3原因:
查看习题详情和答案>>