网址:http://m.1010jiajiao.com/timu3_id_412651[举报]
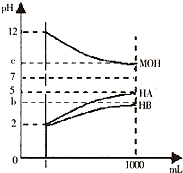
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:

(1)HA为________酸,HB为________酸(填“强”或“弱”)。
(2)若c=9:则
①稀释前HB溶液和MOH溶液等体积混合后,溶液中c(B-) ________c(M+) (填“>”或“<”或“=”)。
②稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为_______________________________________________ (用酸、碱的化学式表示)。
③将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为________(填“大于”“小于”或“等于”)。
(3)若b+c=14,则MOH为________碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH________7(填“大于”“小于”或“等于”)。
查看习题详情和答案>>下列说法正确的是( )
A、常温下,某溶液中有水电离出的C(H+)=10-12mol/L,该溶液可能是酸溶液也可能是强碱弱酸盐溶液.
B、pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-)
C.pH相等的CH3COOH、HCl和H2SO4三种溶液和等体积等物质的量浓度的NaOH反应恰好反应,消耗三种酸的体积:c(CH3COOH)<c(HCl)<c(H2SO4)
D、向0.1mol·L-1氯化铵溶液中加入水,氯化铵的水解程度增大,溶液酸性增强.
![]()
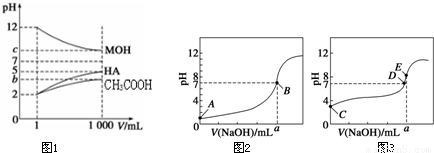
(1)HA为______酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的c(H+)______醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为______碱(填“强”或“弱”).
(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是______.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/(H+)
(3)常温下,用0.10mol?L-1 NaOH溶液分别滴定20mL 0.10mol?L-1 HCl溶液和20mL 0.10 mol?L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是______(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示)______.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为______.
查看习题详情和答案>>
(1)HA为______酸,HB为______酸;(填“强“或“弱“)
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为______(用酸、碱化学式表示);将稀释后的HA溶液利MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为______;(填“大于“、“小于“或“等于“)
(3)若b+c=14,则MQH为______碱(填“强“或“弱“).将稀释后的HB溶液和MOH溶液取等体积混合,所得很合溶液的pH______7(填“大于“、“小于“或“等于“)
(1)HA为______酸,HB为______酸;(填“强“或“弱“)
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为______(用酸、碱化学式表示);将稀释后的HA溶液利MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为______;(填“大于“、“小于“或“等于“)
(3)若b+c=14,则MQH为______碱(填“强“或“弱“).将稀释后的HB溶液和MOH溶液取等体积混合,所得很合溶液的pH______7(填“大于“、“小于“或“等于“)
 查看习题详情和答案>>
查看习题详情和答案>>