摘要:20.为了合理利用化学能.确保安全生产.化工设计需要充分考虑化学反应的焓变.并采取相应措施.化学反应的焓变通常用实验进行测定.也可进行理论推算. ⑴实验测得.1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量.试写出甲醇燃烧的热化学方程式. ⑵由气态基态原子形成 1mol化学键释放的最低能量叫键能.从化学键的角度分析.化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中.拆开化学键需要消耗能量.形成化学键又会释放能量. 已知.CH3-CH3→CH2=CH2+H2,有关化学键的键能如下. 化学键 C-H C=C C-C H-H 键能 414.4 615.3 347.4 435.3 试计算该反应的反应热(在答题纸中写出计算过程). ⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算. 试依据下列热化学方程式.计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变(在答题纸中写出计算过程). ①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l),△H1=-870.3kJ·mol-1 ②C(s)+O2(g) CO2(g),△H2=-393.5kJ·mol-1 ③H2(g)+1/2O2(g) H2O(l),△H3=-285.8kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_41071[举报]
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(3)甲醇是一种清洁高效的能源,若将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为:
查看习题详情和答案>>
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
;(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
;(3)甲醇是一种清洁高效的能源,若将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热△H=
(2)今有如下两个热化学方程式:?则a
O2(g)=H2O(g)△H1=a kJ?mol-1;H2(g)+
O2(g)=H2O(l)△H2=b kJ?mol-1??
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.
已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热△H=
查看习题详情和答案>>
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的燃烧热△H=
-1452.8KJ/mol
-1452.8KJ/mol
.(2)今有如下两个热化学方程式:?则a
>
>
b(填>,=,<)H2(g)+| 1 |
| 2 |
| 1 |
| 2 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.
已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热△H=
+228.2 kJ?mol-1
+228.2 kJ?mol-1
.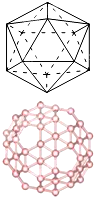 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,1g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇燃烧的热化学方程式:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)?H=-1452.8 kJ?mol-1
(2)自发现富勒烯C60以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究.C60分子是形如球状的多面体,该结构的建立基于以下考虑:削去右图多面体(含12个顶点,20个正三角形)的每一个顶角,得到由一定数目的正五边形和正六边形所组成的多面体,即为C60分子,该多面体中含有90条棱,且每个碳原子都达到了8电子的稳定结构.已知几种共价键的键能数据如下表:
利用下表数据估算得C60分子的燃烧热为
(120d-60a-30b-60e) kJ?mol-1
(120d-60a-30b-60e) kJ?mol-1
.| 化学键 | C-C | C=C | C≡C | C=O | O=O |
| 键能/(kJ?mol-1) | a | b | c | d | e |
80
80
.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)25℃、101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为△H=-57.3kJ/mol,则稀硫酸与氢氧化钾溶液反应的热化学方程式为
(2)实验测得 5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2+3H2?2NH3△H=x kJ?mol-1.试根据表中所列键能数据估算x的数值为
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=akJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=bkJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=ckJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=
l-1.(用含a、b、c的表达式表示)
查看习题详情和答案>>
(1)25℃、101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为△H=-57.3kJ/mol,则稀硫酸与氢氧化钾溶液反应的热化学方程式为
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=-57.3kJ?mol-1
| 1 |
| 2 |
| 1 |
| 2 |
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=-57.3kJ?mol-1
.| 1 |
| 2 |
| 1 |
| 2 |
(2)实验测得 5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
.(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
-93
-93
.(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=akJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=bkJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=ckJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=
2a+
b-
c
| 1 |
| 2 |
| 1 |
| 2 |
2a+
b-
c
kJ?moD| 1 |
| 2 |
| 1 |
| 2 |
l-1.(用含a、b、c的表达式表示)
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2 (g)?2NH3(g)△H=a kJ?mol-1.试根据表中所列键能数据计算a为
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+02(g)=C02(g);△H1=-393.5kJ?mol-1
2H2(g)+02(g)=2H20(l);△H2=-571.6kJ?mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l);△H3=-2599kJ?mol-1
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=
(4)已知热化学方程式:
①Fe2O3(s)+3CO(s)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(s)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(s)=4FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
查看习题详情和答案>>
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-1452.8kJ?mol-1
2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-1452.8kJ?mol-1
.(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N | 键能/kJ?mol-1 | 436 | 391 | 946 |
-92
-92
.(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+02(g)=C02(g);△H1=-393.5kJ?mol-1
2H2(g)+02(g)=2H20(l);△H2=-571.6kJ?mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l);△H3=-2599kJ?mol-1
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=
+226.7kJ?mol-1
+226.7kJ?mol-1
.(4)已知热化学方程式:
①Fe2O3(s)+3CO(s)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(s)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(s)=4FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
FeO(s)+CO(s)=Fe(s)+C02(g)△H=-11kJ/mol
FeO(s)+CO(s)=Fe(s)+C02(g)△H=-11kJ/mol
.