网址:http://m.1010jiajiao.com/timu3_id_41020[举报]
(10分)中学化学中几种常见物质的转化关系如下:(提示:A单质有可变价态且与硫反应生成低价态)
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。
查看习题详情和答案>>
(10分)中学化学中几种常见物质的转化关系如下:(提示:A单质有可变价态且与硫反应生成低价态)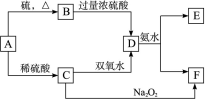
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。
(10分)中学化学中几种常见物质的转化关系如下:(提示:A单质有可变价态且与硫反应生成低价态)
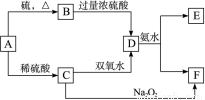
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。
查看习题详情和答案>>
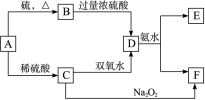
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。
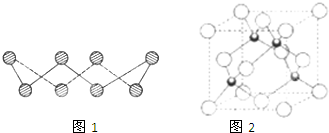
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
(3)34号元素的价层电子的电子排布图为
(4)气态SO2分子的立体构型为
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
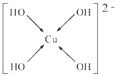

(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是