网址:http://m.1010jiajiao.com/timu3_id_40949[举报]
(10分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: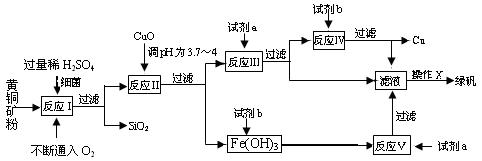

已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的p H如下表:
H如下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。 查看习题详情和答案>>
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
A.高空排放
B.用纯碱溶液吸收制备亚硫酸钠
C.用氨水吸收后,再经氧化制备硫酸铵
D.用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2 ,Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有_____。
A过滤;B加过量NaOH溶液;C蒸发结晶;D灼烧;E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示

(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为? _____________。
(5)该工艺流程中,可以循环利用的物质是_____(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为__mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看习题详情和答案>>
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: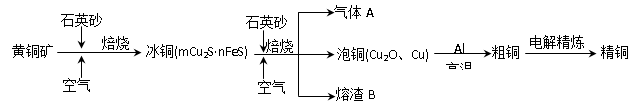
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看习题详情和答案>>
(10分) 以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。
查看习题详情和答案>>