题目内容
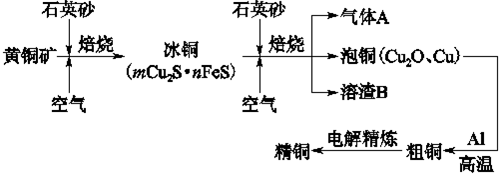
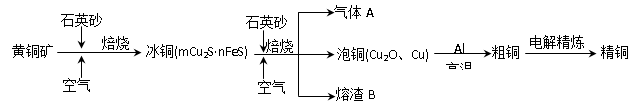
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
(1)c,d(2)加入KSCN溶液,若溶液变为血红色,证明有Fe3+,若无现象,证明没有Fe3+;加入K3[Fe(CN)6]溶液,若生成蓝色沉淀,证明有Fe2+;若无现象,则无Fe2+
3Fe2+ + 2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
4×10-11mol/L (3)3Cu2O+2Al Al2O3+6Cu
Al2O3+6Cu
(4)b,d Al3+、Zn2+、Cu2+ (5)4H++O2+4e-=2H2O
【解析】
试题分析:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体。a、浓H2SO4不能吸收二氧化硫,故a错误;b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;d、氨水与二氧化硫反应生成亚硫酸铵,故d正确,故选cd。(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;若无现象,证明没有Fe3+;检验溶液中还存在Fe2+的方法是加入K3[Fe(CN)6]溶液,若生成蓝色沉淀,证明有Fe2+;若无现象,则无Fe2+,反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。溶液的pH为5时,溶液中OH-的浓度是10-9mol/L,则根据溶度积常数可知,此时Fe3+的浓度= 4×10-11mol/L。
4×10-11mol/L。
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al Al2O3+6Cu。
Al2O3+6Cu。
(4)a、粗铜中含有杂质,则开始阶段阳极不是铜失去电子,但阴极始终是铜离子放电,所以溶液中硫酸铜额浓度是变化但,a不正确。b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,故b正确;c、溶液中Cu2+向阴极移动,故c错误;d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,故d正确,故选bd。
(5)原电池中正极得到电子,所以根据总的反应式可知,正极是氧气得到电子,因此电极反应式是4H++O2+4e-=2H2O。
考点:考查元素化合物的性质、电化学知识、离子检验以及溶度积常数的应用和计算
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力、评价能力以及知识的迁移能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。注意离子的检验是高考的热点,选取的试剂和检验离子反应后要有特殊现象,会运用知识迁移方法解决问题。

 名校课堂系列答案
名校课堂系列答案