网址:http://m.1010jiajiao.com/timu3_id_40938[举报]
(1)若用98% 1.84g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00g铁粉充分反应,收集到224mL(标准状况)气体,剩余固体质量为3.88g,测得反应后的溶液中Fe2+的物质的量为0.14mol(不含Fe3+).则该样品中Fe2+离子的氧化率为
(3)硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4g Cu2S和CuS的混合物在酸性溶液中用40mL 0.150mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2mol/L (NH4)2Fe(SO4)2溶液完全反应.已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)①V的取值范围为
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验
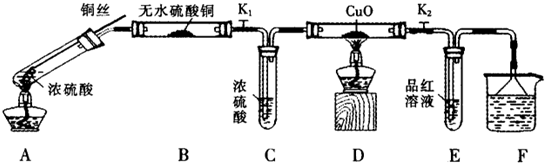
(1)F烧杯中的溶液是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
仅由上述资料可得出的正确结论是
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-) 查看习题详情和答案>>
| ||
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答:
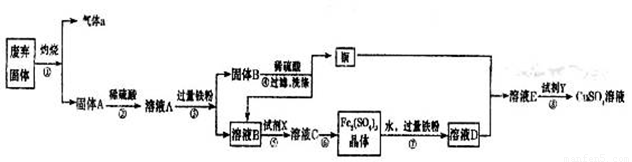
(1)气体a的化学式为 。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式 。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为 。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意 。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
查看习题详情和答案>>