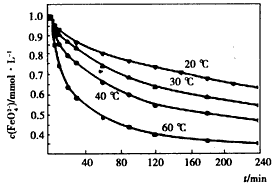
摘要:22.高铁酸钾(K2FeO4)具有极高的氧化性.对环境无不良影响.被人们称为“绿色化学 试剂.某校化学兴趣小组对高铁酸钾进行了如下探究. I.高铁酸钾制备: ①在一定温度下.将氯气通入KOH溶液中制得次氯酸钾溶液,②在剧烈搅拌条件下.将Fe(NO3)3 分批加入次氯酸钾溶液中.控制反应温度.以免次氯酸钾分解,③加 KOH至饱和.使K2FeO4 充分析出.再经纯化得产品. 温度过高会导致次氯酸钾分解生成两种化合物.产物之一是氯酸钾(KClO3).此反应化学方程式是 . II.探究高铁酸钾的某种性质: [实验1]:将适量K2FeO4分别溶解于pH 为 4.74.7.00.11.50 的水溶液中.配得FeO42-浓度均为 1.0mmol·L-1(1mmol·L-1=10-3mol·L-1)的试样.静置.考察不同初始 pH 的水溶液对K2FeO4某种性质的影响.结果见图1(注:800min后.三种溶液中高铁酸钾的浓度不再改变). [实验2]:将适量 K2FeO4 溶解于pH=4.74 的水溶液中.配制成FeO42-浓度为 1.0mmol·L-1 的试样.将试样分别置于 20℃.30℃.40℃和 60℃的恒温水浴中.考察不同温度对K2FeO4某种性质的影响.结果见图2. (1)实验1的目的是 , (2)实验2可得出的结论是 , (3)高铁酸钾在水中的反应为4 FeO42-+10 H2O4 Fe(OH)3 +8OH-+3 O2↑. 由图1可知.800min时.pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高.主要原因是 , 湖南师大附中高三第2次月考试题
网址:http://m.1010jiajiao.com/timu3_id_407289[举报]
| |||||||||||||||||||||||||||
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。

⑴请完成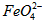 与水反应的化学方程式:
与水反应的化学方程式: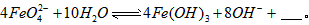
 在处理水的过程中所起的作用是____________和_____________。
在处理水的过程中所起的作用是____________和_____________。
⑵将适量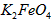 配制成c(
配制成c(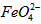 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(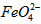 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为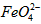 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
⑶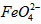 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,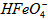 的分布分数先增大后减小
的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为: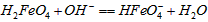
D.向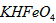 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小
E.等体积等浓度的KOH溶液与溶液混合后溶液中的离子浓度大小关系为:
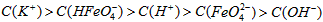
⑷Fe(OH)3在水中存在着沉淀溶解平衡:Fe(OH)3(s)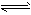 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Ksp[Fe(OH)3]=4.0×10-38。某FeCl3溶液中c(Fe3+)=4.0×10-5 mol·L-1,在25℃时如果要生成Fe(OH)3沉淀,
需要向FeCl3溶液中加入碱溶液来调节溶液的pH,则必须使所得混合溶液的pH大于_________。
查看习题详情和答案>>
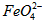 与水反应的化学方程式:
与水反应的化学方程式: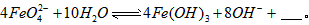
 在处理水的过程中所起的作用是____________和_____________。
在处理水的过程中所起的作用是____________和_____________。⑵将适量
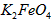 配制成c(
配制成c(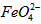 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(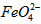 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为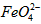 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。⑶
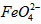 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。 A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,
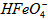 的分布分数先增大后减小
的分布分数先增大后减小C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
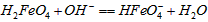
D.向
 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小E.等体积等浓度的KOH溶液与溶液混合后溶液中的离子浓度大小关系为:
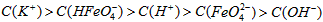
⑷Fe(OH)3在水中存在着沉淀溶解平衡:Fe(OH)3(s)
 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数Ksp[Fe(OH)3]=4.0×10-38。某FeCl3溶液中c(Fe3+)=4.0×10-5 mol·L-1,在25℃时如果要生成Fe(OH)3沉淀,
需要向FeCl3溶液中加入碱溶液来调节溶液的pH,则必须使所得混合溶液的pH大于_________。
如图是某具有高效能的高铁电池的实验装置,已知放电后,两极得到铁的相同价态的化合物。
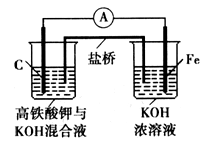
请问答下列问题:
(1)该电池放电时正极发生的电极反应是_________;若该电池属于二次电池,则充电时阴极的电极反应式为_________________
(2)此盐桥中阴离子定向移动的方向是__________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是____。
(3)高铁酸钾具有极姒的氧化性,是一种优良的水处理剂。请完成FeO42- 与水反应的化学方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
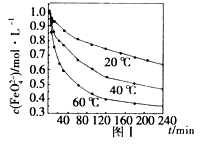
(4)用适量的K2FeO4配制 =1.0 mol·L-1的试液,将试液分别置于20℃、40℃、60℃的恒温水浴中,测出 的变化如图I所示,则(3)中反应的△H_______0(填“>”、“<”或“=”),温度对该反应的反应速率和平衡移动的影响是_______________。
(1)该电池放电时正极发生的电极反应是_________;若该电池属于二次电池,则充电时阴极的电极反应式为_________________
(2)此盐桥中阴离子定向移动的方向是__________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是____。
(3)高铁酸钾具有极姒的氧化性,是一种优良的水处理剂。请完成FeO42- 与水反应的化学方程式:4FeO42-+10H2O
 4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。
4Fe(OH)3+8OH-+_______;K2FeO4在处理水的过程中所起的作用是作净水剂和____。 (4)用适量的K2FeO4配制 =1.0 mol·L-1的试液,将试液分别置于20℃、40℃、60℃的恒温水浴中,测出 的变化如图I所示,则(3)中反应的△H_______0(填“>”、“<”或“=”),温度对该反应的反应速率和平衡移动的影响是_______________。
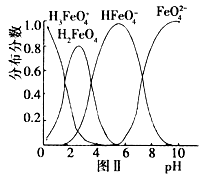
(5) 在水溶液中的存在形态如图Ⅱ所示。下列说法中正确的是___________。
a.无论溶液的酸碱性如何变化,铁元素都有4种存在形态
b.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4- 的分布分数先增大后减小
c.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O)
查看习题详情和答案>>
a.无论溶液的酸碱性如何变化,铁元素都有4种存在形态
b.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4- 的分布分数先增大后减小
c.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O)
饮用水的使用安全是一个刻不容缓的问题。二氧化氯(ClO2)是一种广谱高效的消毒剂,高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。K2FeO4在处理水的过程中所起的作用有_______、
4Fe(OH)3+8OH-+3O2。K2FeO4在处理水的过程中所起的作用有_______、
_____。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol/L的试样,将试样分别置于20℃、
30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见下图。该实验的目的是_____________;发生反应的△H_______0(填“>”、“<”或“=”)。
(1)已知:4FeO42-+10H2O
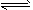 4Fe(OH)3+8OH-+3O2。K2FeO4在处理水的过程中所起的作用有_______、
4Fe(OH)3+8OH-+3O2。K2FeO4在处理水的过程中所起的作用有_______、_____。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol/L的试样,将试样分别置于20℃、
30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见下图。该实验的目的是_____________;发生反应的△H_______0(填“>”、“<”或“=”)。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他 们进行了如下实验:向30. 00 mL水样中加几滴K2CrO4溶液作指示剂,用0.0010 mol/LAgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是___________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是
5. 000×10-3mol/L,则此时溶液中Cl-的浓度是___________。
查看习题详情和答案>>
①水样中Cl-的物质的量浓度是___________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是
5. 000×10-3mol/L,则此时溶液中Cl-的浓度是___________。
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性.
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
查看习题详情和答案>>

(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
;FeO42-发生反应的△H>
>
0(填“>”“<”或“=”)(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
.(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
.电解时阳极发生反应生成FeO42-,该电极反应式为Fe+8OHˉ-6eˉ=FeO42-+4H2O
Fe+8OHˉ-6eˉ=FeO42-+4H2O
.(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
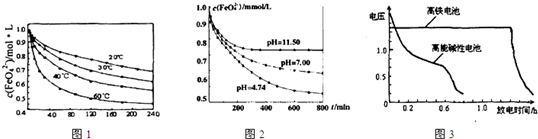
.如图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有放电时间长
放电时间长
、工作电压稳定
工作电压稳定
. 4Fe(OH)3+8OH-+________.
4Fe(OH)3+8OH-+________.

 H++HFeO4-的电离平衡常数表达式为K=________.
H++HFeO4-的电离平衡常数表达式为K=________.