摘要: (1)漏斗.烧杯.玻璃棒 (2)[1]H3AsO3+[1]I2+[1]H2O===[1]H3AsO4+[2]I-+[2]H+ (3)溶液由蓝色变为无色.保持半分钟不变色 (4)IO+5I-+6H+===3I2+3H2O 不合格 [解析]运用得失电子守恒法配平化学方程式.H3AsO3+I2+H2O===H3AsO4+2I-+2H+.IO+5I-+6H+===3I2+3H2O.则I2的物质的量浓度为:=0.001 5 mol/L.根据As-H3AsO3-I2.则As的质量为:0.020 255 L×
网址:http://m.1010jiajiao.com/timu3_id_407142[举报]
现用Na2CO3固体配制500mL 0.200mol?L-1的Na2CO3溶液.可供选择的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒;⑥托盘天平;⑦漏斗.
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有______ (填代号),还缺少的仪器是______(写仪器名称).
(2)经计算,需Na2CO3固体质量为______.
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200mol?L-1.请你分析配制过程中可能引起误差偏低的原因______.
A.定容时俯视液面 B.配制时容量瓶没有干燥
C.转移时没有洗涤烧杯和玻璃棒 D.称量时砝码位置放错.
查看习题详情和答案>>
(2010?深圳二模)市售氯化钾中所含杂质以Na+和Mg2+为主,也含有少量S
、Fe3+等.提纯过程如下: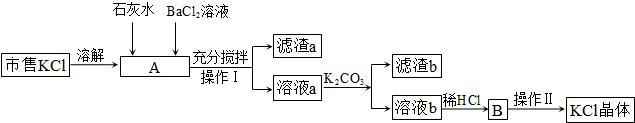
(1)操作 I所用的玻璃仪器有
(2)滤渣b的主要成分是
(3)检验BaCl2溶液是否加入过量,其详细操作过程为
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是
查看习题详情和答案>>
| O | 2- 4 |

(1)操作 I所用的玻璃仪器有
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
;操作 II的主要步骤是蒸发浓缩、降温结晶、过滤
蒸发浓缩、降温结晶、过滤
.(2)滤渣b的主要成分是
CaCO3、BaCO3
CaCO3、BaCO3
.(3)检验BaCl2溶液是否加入过量,其详细操作过程为
向上层清液中滴加BaCl2,若有沉淀生成,则未过量,若无沉淀生成,则已过量
向上层清液中滴加BaCl2,若有沉淀生成,则未过量,若无沉淀生成,则已过量
.(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是
焰色反应
焰色反应
,进一步提纯的方法是重结晶
重结晶
.(2013?烟台一模)某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: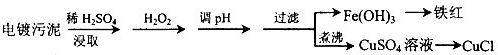
(1)酸浸后加入H2O2的目的是
(2)煮沸CuSO4溶液的原因是
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol?L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+.通过计算说明该CuCl样品
(4)25℃时,KSP[Fe(OH)3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为
查看习题详情和答案>>
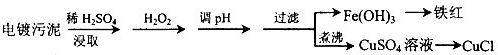
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的PH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的PH | 3.2 | 9.7 | 6.4 |
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3
CuO、或Cu(OH)2、或CuCO3
(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(2)煮沸CuSO4溶液的原因是
除净溶液中的H2O2,避免影响下一步CuCl的生成
除净溶液中的H2O2,避免影响下一步CuCl的生成
.向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
.(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol?L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+.通过计算说明该CuCl样品
符合
符合
(填“符合”或“不符合”)国家标准.(4)25℃时,KSP[Fe(OH)3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为
2.5×10-5
2.5×10-5
.(2012?潍坊一模)绿矾(FeSO4?7H2O)是治疗缺铁性盆血药品的重要成分.实验室利用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备绿矾的过程如下:
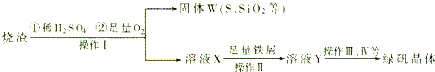
(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用

(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有
(3)写出溶液X中加铁屑发生反应的离子方程式
(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol?L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO
+8H+═5Fe3++Mn2++4H2O)
①计算上述产品中FeSO4?7H2O的质量分数为
②若用上述方法测定的产品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)
查看习题详情和答案>>
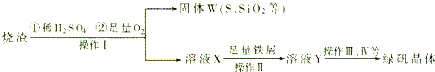
(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用
AD
AD
(填字母);若选用E装置,则烧杯中的下层液体可以是四氯化碳
四氯化碳
(填名称).
(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(3)写出溶液X中加铁屑发生反应的离子方程式
2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑
2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑
.(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol?L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO
- 4 |
①计算上述产品中FeSO4?7H2O的质量分数为
97.5%
97.5%
.②若用上述方法测定的产品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)
产品中存在少量的杂质或产品部分被氧化
产品中存在少量的杂质或产品部分被氧化
.食盐是日常生活的必需品,也是重要的化工原料.
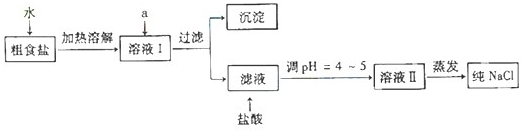
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②过滤之前,怎样检验SO42-已除去:
③过滤所需要的玻璃仪器有
④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(2)用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有
②计算后,需称出NaOH质量为
③下列操作的正确顺序是(用字母表示)
A.摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A 定容时仰视容量瓶刻度线:
查看习题详情和答案>>
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3
(只填化学式).②过滤之前,怎样检验SO42-已除去:
取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全
取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全
.③过滤所需要的玻璃仪器有
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度
生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度
.(2)用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有
250ml容量瓶、托盘天平、胶头滴管
250ml容量瓶、托盘天平、胶头滴管
(填仪器名称).②计算后,需称出NaOH质量为
29.3
29.3
g.③下列操作的正确顺序是(用字母表示)
B→E→F→C→D→A→G
B→E→F→C→D→A→G
.A.摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A 定容时仰视容量瓶刻度线:
偏低
偏低
.B 称量时砝码生锈:偏高
偏高
.