题目内容
食盐是日常生活的必需品,也是重要的化工原料.
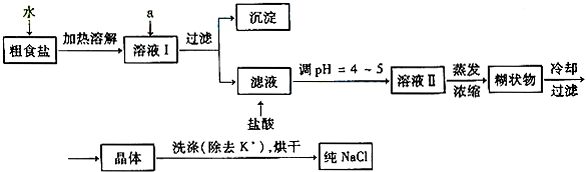
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②过滤之前,怎样检验SO42-已除去:
③过滤所需要的玻璃仪器有
④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(2)用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有
②计算后,需称出NaOH质量为
③下列操作的正确顺序是(用字母表示)
A.摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A 定容时仰视容量瓶刻度线:
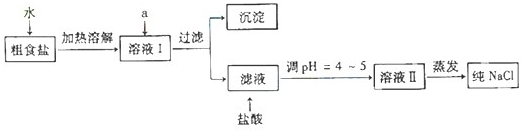
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3
(只填化学式).②过滤之前,怎样检验SO42-已除去:
取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全
取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全
.③过滤所需要的玻璃仪器有
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度
生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度
.(2)用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有
250ml容量瓶、托盘天平、胶头滴管
250ml容量瓶、托盘天平、胶头滴管
(填仪器名称).②计算后,需称出NaOH质量为
29.3
29.3
g.③下列操作的正确顺序是(用字母表示)
B→E→F→C→D→A→G
B→E→F→C→D→A→G
.A.摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A 定容时仰视容量瓶刻度线:
偏低
偏低
.B 称量时砝码生锈:偏高
偏高
.
分析:(1)①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,可以分别采用碳酸钠、氢氧化钠、氢氧化钠和氯化钡,根据试剂的添加原则来回答;
②依据硫酸根离子的检验方法分析;
③依据过滤操作和装置分析回答;
④生成的沉淀会溶解于盐酸中,影响氯化钠的纯度;
(2)①依据配制溶液步骤和操作分析写出仪器;
②依据250mL 2.00mol?L-1NaCl溶液计算溶质物质的量,依据摩尔质量计算氯化钠质量;
③依据溶液配制步骤是计算、称量、溶解、转移、洗涤转移,加水定容、摇匀、装瓶;
④A、定容时仰视容量瓶刻度线,刻度定液面;
B、称量时砝码生锈,称量结果会称多.
②依据硫酸根离子的检验方法分析;
③依据过滤操作和装置分析回答;
④生成的沉淀会溶解于盐酸中,影响氯化钠的纯度;
(2)①依据配制溶液步骤和操作分析写出仪器;
②依据250mL 2.00mol?L-1NaCl溶液计算溶质物质的量,依据摩尔质量计算氯化钠质量;
③依据溶液配制步骤是计算、称量、溶解、转移、洗涤转移,加水定容、摇匀、装瓶;
④A、定容时仰视容量瓶刻度线,刻度定液面;
B、称量时砝码生锈,称量结果会称多.
解答:解:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+,故答案为:BaCl2、NaOH、Na2CO3;
②取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全,故答案为:取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全;
③过滤装置需要用到的玻璃仪器是漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
④先用盐酸调pH再过滤,生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,过滤后不能提纯氯化钠;
故答案为:生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度;
(2)①用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液,需要的仪器有烧杯,玻璃棒、250ml容量瓶、胶头滴管、托盘天平;其中烧杯、玻璃棒是上述实验用到,还需要250ml容量瓶、胶头滴管、托盘天平;故答案为:250ml容量瓶、胶头滴管、托盘天平;
②配制250mL 2.00mol?L-1NaCl溶液中溶质物质的量=0.25L×2.00mol/L=0.5mol,氯化钠质量=0.5mol×58.5g/mol=29.25g;但托盘天平只能称量到0.1g,所以需要称量氯化钠质量29.3g,
故答案为:29.3;
③溶液配制步骤是计算、称量、溶解、转移、洗涤转移,加水定容、摇匀、装瓶;所以操作的正确顺序是B→E→F→C→D→A→G,故答案为;B→E→F→C→D→A→G;
④A、定容时仰视容量瓶刻度线,分析依据是刻度定液面,仰视加水超过刻度线,浓度偏低;故答案为:偏低;
B、称量时砝码生锈,砝码质量增大,称量氯化钠质量增大,结果偏高;故答案为:偏高.
②取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全,故答案为:取少量待测液于试管中,向其中滴加氯化钡溶液,看是否有沉淀生成,若没有沉淀,则硫酸根离子已沉淀完全;
③过滤装置需要用到的玻璃仪器是漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
④先用盐酸调pH再过滤,生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,过滤后不能提纯氯化钠;
故答案为:生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制的食盐的纯度;
(2)①用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液,需要的仪器有烧杯,玻璃棒、250ml容量瓶、胶头滴管、托盘天平;其中烧杯、玻璃棒是上述实验用到,还需要250ml容量瓶、胶头滴管、托盘天平;故答案为:250ml容量瓶、胶头滴管、托盘天平;
②配制250mL 2.00mol?L-1NaCl溶液中溶质物质的量=0.25L×2.00mol/L=0.5mol,氯化钠质量=0.5mol×58.5g/mol=29.25g;但托盘天平只能称量到0.1g,所以需要称量氯化钠质量29.3g,
故答案为:29.3;
③溶液配制步骤是计算、称量、溶解、转移、洗涤转移,加水定容、摇匀、装瓶;所以操作的正确顺序是B→E→F→C→D→A→G,故答案为;B→E→F→C→D→A→G;
④A、定容时仰视容量瓶刻度线,分析依据是刻度定液面,仰视加水超过刻度线,浓度偏低;故答案为:偏低;
B、称量时砝码生锈,砝码质量增大,称量氯化钠质量增大,结果偏高;故答案为:偏高.
点评:本题考查了粗盐提纯的实验方案设计,试剂选择依据,离子检验方法,配制溶液的步骤和仪器使用,误差分析判断,题目难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目