网址:http://m.1010jiajiao.com/timu3_id_406425[举报]
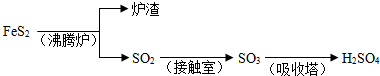
填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式______;
(2)接触室内发生的反应为:
SO2(g)+
| 1 |
| 2 |
| ||
| △ |
下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
②K值越大,表明反应达到平衡时______(填标号).
A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是______(填标号);
A.Fe2O3
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成______个实验然后进行对比得出结论;
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏______千克;(取两位有效数字)(设二氧化硫的利用率为80.0% )
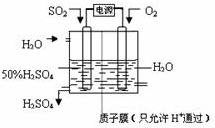
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为______,总反应的化学方程式为______.
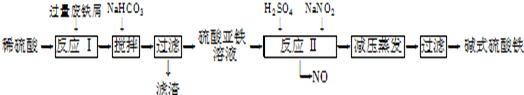
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是 ;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 ,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+聚合离子.该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为
FeSO4生成速率,采取下列措施中正确的是
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+?4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
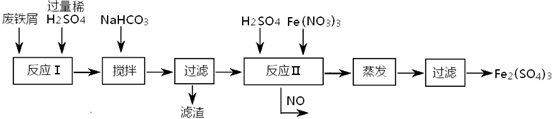
①加入NaHCO3并搅拌,将混合液pH调控至
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。

(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为 。若要提高FeSO4生成速率,采取下列措施中正确的是 。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是 。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行 、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:

①加入NaHCO3并搅拌,将混合液pH调控至 范围内,使杂质沉淀过滤除去。
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Cu(OH)2 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
4.7 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
6.7 |
②反应Ⅱ中反应的离子方程式是: 。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是 ,气体X与NO配比的比例是 。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是 。
查看习题详情和答案>>