题目内容
 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为
FeSO4生成速率,采取下列措施中正确的是
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
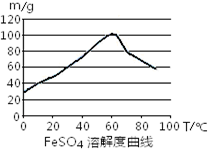
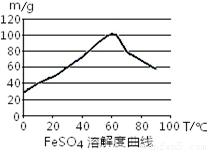
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+?4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
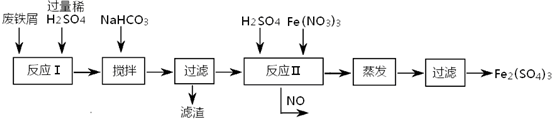
①加入NaHCO3并搅拌,将混合液pH调控至
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是
分析:(1)①根据离子方程式的书写规则来进行书写;一般增大接触面积、增大浓度、增大压强、升高温度,反应的反应速率增大,以此来解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+?4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
③不溶性固体和溶液的分离,应为过滤操作;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+?4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
③不溶性固体和溶液的分离,应为过滤操作;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;
解答:解:(1)①铁屑与稀硫酸反应:H2SO4+Fe═FeSO4+H2↑,铁为单质写化学式,硫酸是强酸拆写成离子形式,硫酸亚铁是强电解质拆写成离子形式,所以离子方程式为Fe+2H+=Fe2++H2↑;
A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.控制温度在80~100℃,稀硫酸在100℃变成了气态,不利于铁和稀硫酸充分反应,在该温度硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故答案为:Fe+2H+=Fe2++H2↑;B、C;
②A.较浓的硫酸对于4Fe2++O2+4H+?4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
③用铁屑与稀硫酸反应制备FeSO4,含有不溶性固体过量的铁,过量的铁和溶液硫酸亚铁分离,应为过滤操作,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,
故答案为:过滤;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;
A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.控制温度在80~100℃,稀硫酸在100℃变成了气态,不利于铁和稀硫酸充分反应,在该温度硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故答案为:Fe+2H+=Fe2++H2↑;B、C;
②A.较浓的硫酸对于4Fe2++O2+4H+?4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
③用铁屑与稀硫酸反应制备FeSO4,含有不溶性固体过量的铁,过量的铁和溶液硫酸亚铁分离,应为过滤操作,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,
故答案为:过滤;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;
点评:本题考查铁屑与稀硫酸反应制备FeSO4,读懂工艺流程,熟练运用氧化还原反应原理、平衡移动原理是解答的关键,题目难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用。
(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为 。若要提高FeSO4生成速率,采取下列措施中正确的是 。
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是 。
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4) >1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行 、冷却、过滤、洗涤即得FeSO4·7H2O晶体。
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
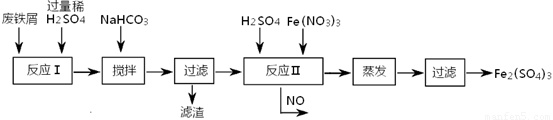
①加入NaHCO3并搅拌,将混合液pH调控至 范围内,使杂质沉淀过滤除去。
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Cu(OH)2 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
4.7 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
6.7 |
②反应Ⅱ中反应的离子方程式是: 。
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是 ,气体X与NO配比的比例是 。
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是 。