网址:http://m.1010jiajiao.com/timu3_id_405141[举报]
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
(3)除去粗铜中锌、银等金属
(4)除去水中的Na+、SO42-、Cl-等杂质
(5)除去KNO3晶体中混有的少量NaCl
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=
| 0.418×2.35 |
| 0.025 |
| 0.418×2.35 |
| 0.025 |
I.可用于分离或提纯物质的方法有:
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠______;
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠______;
(3)除去粗铜中锌、银等金属______;
(4)除去水中的Na+、S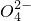 、Cl-等杂质______;
、Cl-等杂质______;
(5)除去KNO3晶体中混有的少量NaCl______.
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=______KJ/mol(填数学计算式).[反应后混合液的比热容为4.18J/(g?℃)]. 查看习题详情和答案>>
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br
+ H2O
CH3CH2Br
+ H2O
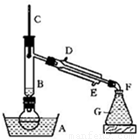
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。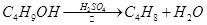
|
物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
|
密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
|
熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
|
沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
|
在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
查看习题详情和答案>>
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
| 硫酸 |
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
| 物质 数据 |
乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g?cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了
(5)粗产品中含有的主要有机液体杂质是
食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳。实验室提纯NaCl的流程如下:
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—离子,选出A所代表的多种试剂,按滴加顺序依次为i NaOH ii iii (填化学式)。
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i: ;
加入试剂iii: 。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂 为 。(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如下:
欲用上述浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有 (填仪器名称)
②需量取的浓盐酸的体积为: 。