题目内容
I.可用于分离或提纯物质的方法有:
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠______;
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠______;
(3)除去粗铜中锌、银等金属______;
(4)除去水中的Na+、S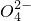 、Cl-等杂质______;
、Cl-等杂质______;
(5)除去KNO3晶体中混有的少量NaCl______.
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=______KJ/mol(填数学计算式).[反应后混合液的比热容为4.18J/(g?℃)].
解:I.(1)淀粉溶液属于胶体,碘化钠是小分子物质,可以利用渗析提纯淀粉溶液,故选:F;
(2)从油脂皂化反应后的混合液中含有高级脂肪酸钠、甘油等,采取盐析的方法降低高级脂肪酸钠的溶解度,与甘油分离,故选:B;
(3)除去粗铜中锌、银等金属,粗铜的精炼可以利用电解原理,故选:G;
(4)除去水中的Na+、S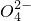 、Cl-等可溶性杂质,通常采取蒸馏的方法,故选:A;
、Cl-等可溶性杂质,通常采取蒸馏的方法,故选:A;
(5)KNO3的溶解度受温度影响比较大,NaCl的溶解度受温度影响不大,可以采取重结晶的方法,故选:D;
II.由表中数据可知,硫酸铜晶体的质量为(W2-W1)g,晶体中含有的水的质量为(W2-W3)g,晶体中硫酸铜的质量为(W3-W1)g,令硫酸铜晶体的组成为CuSO4?xH20,利用质量之比等于式量之比,则160:18x=(W3-W1)g:(W2-W3)g,解得x= ,
,
故答案为: ;
;
III、混合后溶液质量为100mL×1g/mL=100g,溶液的平均温度升高为 =2.35℃,所以放出的热量Q=4.18J/(g?℃)×100g×2.35℃=4.18×100×2.35J=0.418×2.35kJ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
=2.35℃,所以放出的热量Q=4.18J/(g?℃)×100g×2.35℃=4.18×100×2.35J=0.418×2.35kJ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
所以,△H=-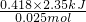 =-
=-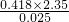 kJ/mol,故答案为:-
kJ/mol,故答案为:-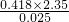 .
.
分析:I.(1)淀粉溶液属于胶体,碘化钠是小分子物质,可以利用渗析提纯淀粉溶液;
(2)从油脂皂化反应后的混合液中含有高级脂肪酸钠、甘油等,采取盐析的方法降低高级脂肪酸钠的溶解度,与甘油分离;
(3)除去粗铜中锌、银等金属,粗铜的精炼可以利用电解原理;
(4)除去水中的Na+、S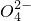 、Cl-等可溶性杂质,通常采取蒸馏的方法;
、Cl-等可溶性杂质,通常采取蒸馏的方法;
(5)KNO3的溶解度受温度影响比较大,NaCl的溶解度受温度影响不大,可以采取重结晶的方法;
II.由表中数据可知,硫酸铜晶体的质量为(W2-W1)g,晶体中含有的水的质量为(W2-W3)g,晶体中硫酸铜的质量为(W3-W1)g,令硫酸铜晶体的组成为CuSO4?xH20,利用质量之比等于式量之比列方程计算x的值;
III、每次反应物的浓度、体积相同,放出的热量应相同,测量溶液的温度应相差不大,第三次温度相差较大,应将该组数据去掉,取第①、②组的温度,计算平均值即为溶液的温度的升高值,溶液的浓度较稀,密度近似为1g/mL,根据m=ρV计算后溶液的质量,混合后溶液的体积为两溶液体积之和,根据Q=cm△t计算放出的热量,反应热△H=-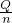 ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
点评:本题考查物质的量分离提纯、中和热测定、物质的组成测定等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.
(2)从油脂皂化反应后的混合液中含有高级脂肪酸钠、甘油等,采取盐析的方法降低高级脂肪酸钠的溶解度,与甘油分离,故选:B;
(3)除去粗铜中锌、银等金属,粗铜的精炼可以利用电解原理,故选:G;
(4)除去水中的Na+、S
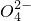 、Cl-等可溶性杂质,通常采取蒸馏的方法,故选:A;
、Cl-等可溶性杂质,通常采取蒸馏的方法,故选:A;(5)KNO3的溶解度受温度影响比较大,NaCl的溶解度受温度影响不大,可以采取重结晶的方法,故选:D;
II.由表中数据可知,硫酸铜晶体的质量为(W2-W1)g,晶体中含有的水的质量为(W2-W3)g,晶体中硫酸铜的质量为(W3-W1)g,令硫酸铜晶体的组成为CuSO4?xH20,利用质量之比等于式量之比,则160:18x=(W3-W1)g:(W2-W3)g,解得x=
 ,
,故答案为:
 ;
;III、混合后溶液质量为100mL×1g/mL=100g,溶液的平均温度升高为
 =2.35℃,所以放出的热量Q=4.18J/(g?℃)×100g×2.35℃=4.18×100×2.35J=0.418×2.35kJ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
=2.35℃,所以放出的热量Q=4.18J/(g?℃)×100g×2.35℃=4.18×100×2.35J=0.418×2.35kJ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.所以,△H=-
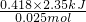 =-
=-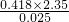 kJ/mol,故答案为:-
kJ/mol,故答案为:-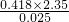 .
.分析:I.(1)淀粉溶液属于胶体,碘化钠是小分子物质,可以利用渗析提纯淀粉溶液;
(2)从油脂皂化反应后的混合液中含有高级脂肪酸钠、甘油等,采取盐析的方法降低高级脂肪酸钠的溶解度,与甘油分离;
(3)除去粗铜中锌、银等金属,粗铜的精炼可以利用电解原理;
(4)除去水中的Na+、S
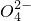 、Cl-等可溶性杂质,通常采取蒸馏的方法;
、Cl-等可溶性杂质,通常采取蒸馏的方法;(5)KNO3的溶解度受温度影响比较大,NaCl的溶解度受温度影响不大,可以采取重结晶的方法;
II.由表中数据可知,硫酸铜晶体的质量为(W2-W1)g,晶体中含有的水的质量为(W2-W3)g,晶体中硫酸铜的质量为(W3-W1)g,令硫酸铜晶体的组成为CuSO4?xH20,利用质量之比等于式量之比列方程计算x的值;
III、每次反应物的浓度、体积相同,放出的热量应相同,测量溶液的温度应相差不大,第三次温度相差较大,应将该组数据去掉,取第①、②组的温度,计算平均值即为溶液的温度的升高值,溶液的浓度较稀,密度近似为1g/mL,根据m=ρV计算后溶液的质量,混合后溶液的体积为两溶液体积之和,根据Q=cm△t计算放出的热量,反应热△H=-
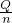 ,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.
,参加反应的n(HCl)=0.05L×0.50mol?L-1=0.025mol.点评:本题考查物质的量分离提纯、中和热测定、物质的组成测定等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目