摘要:19.(1)Si3N4.SiCl4,(2)Si3N4+6H2O =3SiO2+4NH3,(3)氮化硅的导热性差.热量不易损失 (4)BCD 解析:(1)因G中含有硅元素.且由化合物E与NH3反应而生成G和HCl气体.故G中含有的元素为硅和氮.E中含有的元素为硅和氯.根据G中各元素的质量分数有n=:=3:4.故其化学式为Si3N4.1NH3 + 0.75E→0.25Si3N4+ 3HCl.根据原子守恒.可得E的化学式为SiCl4. (2)根据题目所述.Si3N4与O2反应时得到氧化物为SiO2和N2(因N2性质相当稳定.一般情况下不与O2发生反应).故可推知Si3N4与H2O反应是生成的物质为SiO2和NH3. (3)因硅原子和氮原子间以共价键结合.由于N得电子能力比Si强.共用电子对偏向与N原子.氮元素显负价.根据最外层电子数可得硅显+4.氮显-3价.根据Si3N4和其最外层电子数成键情况可知选项B正确.根据题述可知选项D正确
网址:http://m.1010jiajiao.com/timu3_id_404471[举报]
SiCl4与过量的液氨反应生成化合物Si(NH2)4,将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体.氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的作用.氮化硅所属的晶体类型是
[ ]
A.原子晶体
B.分子晶体
C.离子晶体
D.金属晶体
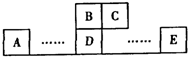 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为
原子晶体
原子晶体
;乙的化学式为Si3N4
Si3N4
.(2)B、D分别可与E形成化合物丙、丁,丙属于
非极性
非极性
(填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:Si3N4>SiC>SiCl4>CCl4
Si3N4>SiC>SiCl4>CCl4
.(用化学式表示)(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式
(CN)2+2OH-=CN-+CNO-+H2O
(CN)2+2OH-=CN-+CNO-+H2O
.(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式
3NCl3+5H2O=2NO+HNO3+9HCl
3NCl3+5H2O=2NO+HNO3+9HCl
.下列说法正确的是( )
| A、利用红外光谱可测定原子或基团的相对原子(分子)质量 | B、利用盖斯定律,可计算某些难以直接测量的反应的焓变 | C、沸点:AsH3>PH3>NH3,熔点:Si3N4>NaCl>SiCl4,酸性:HClO4>H2SO4>H3PO4 | D、蛋白质、油脂、PE、淀粉、醋酸纤维均为可水解的高分子化合物 |
硅及其化合物对人类现代文明具有特殊贡献.请回答下列有关问题:
(1)硅原子的结构示意图: ;
(2)下列物品或设备所用材料属于硅酸盐的是 ;
①长江三峡水泥大坝②石英光导纤维③陶瓷坩埚④普通玻璃⑤硅太阳能电池
A.①②③B.③④⑤C.②③④D.①③④
(3)常温下,SiCl4为液态,沸点为57.6℃,在空气中冒白雾.制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是 ;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因: ;
(4)工业上可用SiCl4(g)制备高温结构陶瓷氮化硅,其反应方程式为:
3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g);△H=akJ?mol(a<0)
①该反应的平衡常数表达式K= ;
②在密闭恒容容器中,能表示上述反应达到平衡状态的是 ;
A.3v逆(N2)=v正(H2) B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变 D.c(N2):c(H2):c(HCl)=1:3:6
③在某条件下达到平衡时,H2与HCl物质的量之比为m:n;保持其他条件不变,降低温度达到新平衡时,H2与HCl物质的量之比 m:n(填“>”“=”或“<”).
查看习题详情和答案>>
(1)硅原子的结构示意图:
(2)下列物品或设备所用材料属于硅酸盐的是
①长江三峡水泥大坝②石英光导纤维③陶瓷坩埚④普通玻璃⑤硅太阳能电池
A.①②③B.③④⑤C.②③④D.①③④
(3)常温下,SiCl4为液态,沸点为57.6℃,在空气中冒白雾.制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是
(4)工业上可用SiCl4(g)制备高温结构陶瓷氮化硅,其反应方程式为:
3SiCl4(g)+2N2(g)+6H2(g)
| 高温 |
①该反应的平衡常数表达式K=
②在密闭恒容容器中,能表示上述反应达到平衡状态的是
A.3v逆(N2)=v正(H2) B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变 D.c(N2):c(H2):c(HCl)=1:3:6
③在某条件下达到平衡时,H2与HCl物质的量之比为m:n;保持其他条件不变,降低温度达到新平衡时,H2与HCl物质的量之比
硅在材料王国中具有举足轻重的位置.请解答下列试题:
(1)硅的制备方法是制约太阳能发展的瓶颈,硅的制备原料是石英砂,石英与焦炭在高温电炉中反应可以制得硅.该反应的化学方程式是 ,该反应的气体产物是一氧化碳,不是二氧化碳,其原因是 .
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4对空气和水都不稳定.但将粉末状的Si3N4和适量氧化镁在230×1.01×l05Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2.
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式 ;
②现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该制造方法称为: ;反应的化学方程式为 ;该法还可制造金刚石薄膜,反应的化学方程式为 .
③在Si3N4和适量氧化镁在230×1.01×105 Pa和185℃的密闭容器中热处理的过程中,除生成Mg3N2外,还可能生成 物质.热处理后除去MgO和Mg3N2的方法是 .
查看习题详情和答案>>
(1)硅的制备方法是制约太阳能发展的瓶颈,硅的制备原料是石英砂,石英与焦炭在高温电炉中反应可以制得硅.该反应的化学方程式是
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4对空气和水都不稳定.但将粉末状的Si3N4和适量氧化镁在230×1.01×l05Pa和185℃的密闭容器中热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到对水不稳定的Mg3N2.
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式
②现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该制造方法称为:
③在Si3N4和适量氧化镁在230×1.01×105 Pa和185℃的密闭容器中热处理的过程中,除生成Mg3N2外,还可能生成