摘要:8/2=0.4 mol / L. X 2 Z 起始浓度 1 1 0 0 转化浓度 0.2 0.6 0.4 0.4 平衡浓度 0.8 0.4 0.4 0.4 所以a=2.平衡时X的浓度为0.8 mol / L.Y的转化率为0.6/1=60%.反应速率 v(Y)=0.6/2=0.3 mol / .
网址:http://m.1010jiajiao.com/timu3_id_404457[举报]
X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:
(1)写出XY2分子的电子式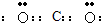
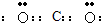 .
.
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
查看习题详情和答案>>
(1)写出XY2分子的电子式
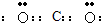
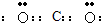
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
H2SO4
H2SO4
.工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
.②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
B
B
(选填字母).A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
C
C
.A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
SO2+2CO
S+2CO2
| ||
| △ |
SO2+2CO
S+2CO2
.
| ||
| △ |
(9分)把0.8 mol X 气体和0.4 mol Y 气体混合于2 L 密闭容器中,使它们发生如下反应:2 X(g)+ Y (g) n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度。
(3)化学反应方程式中n 值是多少?
查看习题详情和答案>>
把0.8 mol X气体和0.4 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g)![]() nZ(g)+2W(g).2 min末已生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
nZ(g)+2W(g).2 min末已生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度.
(3)化学反应方程式中n值是多少?
有四种短周期元素的部分性质如下,请根据有关信息填空:
注:气体密度已换算为标准状况
(1)元素W在周期表中的位置
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为
 ,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置
第三周期第ⅠA族
第三周期第ⅠA族
,根据性质描述,元素Z的单质是石墨
石墨
(写名称),上述元素的简单离子中半径最小的是Na+
Na+
(写离子符号).(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
HF>HCl>H2S
HF>HCl>H2S
(用化学式表示).(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
b
b
(选填序号).a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为


C(s)+O2(g)=CO2△H=-393.51kJ/mol
C(s)+O2(g)=CO2△H=-393.51kJ/mol
.