网址:http://m.1010jiajiao.com/timu3_id_404312[举报]
 完成下列各题
完成下列各题(1)NH3?H2O的电离方程式为NH3?H2O
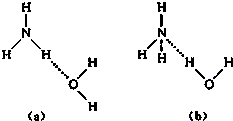
 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是(2)沼气是一种很好的能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则该反应的热化学方程式是
(3)下列分子中所有原子都满足最外层8电子结构的单质是
A.氯仿(CHCl3) B.N2 C.BrCl D.NH2D E.CH4 F.H2O G.CO2 H.He
(4)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量
物质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:
①完成并配平上述反应的化学方程式.
②此反应的氧化剂是
③H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性.
 完成下列各题
完成下列各题
(1)NH3?H2O的电离方程式为NH3?H2O  NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是______(填字母).
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是______(填字母).
(2)沼气是一种很好的能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则该反应的热化学方程式是______
(3)下列分子中所有原子都满足最外层8电子结构的单质是______,是非极性分子的化合物的是______(填序号).
A.氯仿(CHCl3) B.N2 C.BrCl D.NH2D E.CH4 F.H2O G.CO2 H.He
(4)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量
物质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:
______C+______K2Cr2O7+______H2SO4(稀)=______CO2+______K2SO4+______Cr2(SO4)3+______
①完成并配平上述反应的化学方程式.
②此反应的氧化剂是______,被氧化的元素所对应的产物是______.
③H2SO4在上述反应中表现出来的性质是______(填选项编号).
A.酸性 B.氧化性 C.吸水性 D.脱水性.
查看习题详情和答案>>
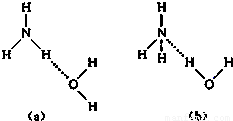
(1)NH3?H2O的电离方程式为NH3?H2O
 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是______(填字母).
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是______(填字母).(2)沼气是一种很好的能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则该反应的热化学方程式是______
(3)下列分子中所有原子都满足最外层8电子结构的单质是______,是非极性分子的化合物的是______(填序号).
A.氯仿(CHCl3) B.N2 C.BrCl D.NH2D E.CH4 F.H2O G.CO2 H.He
(4)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量
物质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:
______C+______K2Cr2O7+______H2SO4(稀)=______CO2+______K2SO4+______Cr2(SO4)3+______
①完成并配平上述反应的化学方程式.
②此反应的氧化剂是______,被氧化的元素所对应的产物是______.
③H2SO4在上述反应中表现出来的性质是______(填选项编号).
A.酸性 B.氧化性 C.吸水性 D.脱水性.
 查看习题详情和答案>>
查看习题详情和答案>>
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)=c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、![]() c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
C、c(Na+)>c(CO32—)> c(HCO3—)> c(OH—)>c(H+)
D、c(Na+)>c(HCO3—)> c(CO32—)> c(OH—)>c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2OH++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、 c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
C、c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+)
D、c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2O H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>