题目内容
 完成下列各题
完成下列各题(1)NH3?H2O的电离方程式为NH3?H2O
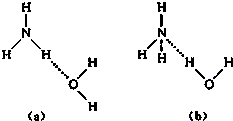
 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是b
b
(填字母).(2)沼气是一种很好的能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则该反应的热化学方程式是
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
(3)下列分子中所有原子都满足最外层8电子结构的单质是
B
B
,是非极性分子的化合物的是EG
EG
(填序号).A.氯仿(CHCl3) B.N2 C.BrCl D.NH2D E.CH4 F.H2O G.CO2 H.He
(4)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量
物质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:
3
3
C+2
2
K2Cr2O7+8
8
H2SO4(稀)=3
3
CO2+2
2
K2SO4+2
2
Cr2(SO4)3+8
8
①完成并配平上述反应的化学方程式.
②此反应的氧化剂是
K2Cr2O7
K2Cr2O7
,被氧化的元素所对应的产物是CO2
CO2
.③H2SO4在上述反应中表现出来的性质是
A
A
(填选项编号).A.酸性 B.氧化性 C.吸水性 D.脱水性.
分析:(1)氨水的电离生成NH4+、OH-,说明NH3?H2O 中O-H键发生断裂,来确定氨水的结构和成键情况;
(2)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
(3)共价化合物的各原子满足“最外层电子数+|化合价|=8”的具有8电子结构,单质分子“最外层电子数+共用电子对数目=8”满足最外层为8电子结构;
由非极性键结合而成的双原子分子一定是非极性分子,由极性键结合而成的双原子分子一定是极性分子,由共价键(极性键或非极性键)结合而成的多原子分子,可能是极性分子,也可能是非极性分子,这主要取决于分子的空间构型.分子空间结构完全对称的是非极性分子,分子空间结构不对称的是极性分子.
(4)①根据氧化还原反应的配平解答;
②氧化剂是指所含元素化合价降低的反应物,化合价升高的元素被氧化.
③根据反应前后硫酸根的数目判断.
(2)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
(3)共价化合物的各原子满足“最外层电子数+|化合价|=8”的具有8电子结构,单质分子“最外层电子数+共用电子对数目=8”满足最外层为8电子结构;
由非极性键结合而成的双原子分子一定是非极性分子,由极性键结合而成的双原子分子一定是极性分子,由共价键(极性键或非极性键)结合而成的多原子分子,可能是极性分子,也可能是非极性分子,这主要取决于分子的空间构型.分子空间结构完全对称的是非极性分子,分子空间结构不对称的是极性分子.
(4)①根据氧化还原反应的配平解答;
②氧化剂是指所含元素化合价降低的反应物,化合价升高的元素被氧化.
③根据反应前后硫酸根的数目判断.
解答:解:(1)NH3溶于水后,形成的NH3?H2O中,根据NH3?H2O的电离方程式为NH3?H2O NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
(2)0.5mol CH4在氧气中燃烧生成CO2和液态水,放出445kJ热量,则1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,所以热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol.
(3)A、氯仿(CHCl3)中H原子不具有8电子结构.空间结构是四面体但不对称,是极性分子;
B.N2 是单质,分子中含有3对共用电子对,N原子原子的最外层电子数是5,具有8电子结构.由非极性键结合而成的双原子分子,是非极性分子;
C.BrCl 原子间有1对共用电子对,原子的最外层电子数是7,都具有8电子结构.是由极性键结合而成的双原子分子.是极性分子;
D.NH2D 中H原子不具有8电子结构. 是三角锥型,不对称,是极性分子;
E.CH4 中H原子不具有8电子结构.空间结构是正四面体对称结构,是非极性分子;
F.H2O 中H原子不具有8电子结构.空间结构是角型不对称结构,是极性分子;
G.CO2 中C原子、O原子都满足“最外层电子数+|化合价|=8”的,具有8电子结构.是直线对称型结构,是非极性分子;
H.He是单质,原子的最外层电子数是2,不具有8电子结构.是单原子分子,是非极性分子.
所以满足最外层8电子结构的单质是B,是非极性分子的化合物的是EG.
故答案为:B; E G
(4)①根据氧化还原反应配平,该反应为3 C+2 K2Cr2O7+8 H2SO4(稀)=3 CO2+2 K2SO4+2 Cr2(SO4)3+8 H2O.
故答案为:3; 2; 8;3;2; 2;8
②K2Cr2O7中的Cr元素化合价由+6价降至+3价,所以K2Cr2O7是氧化剂;C元素化合价由0价升至CO2中+4价,被氧化,被氧化的元素所对应的产物是CO2.
故答案为:K2Cr2O7;CO2
③反应前后硫酸所含元素化合价未变,硫酸根的数目相等,故硫酸起酸的作用.
故选:A
 NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);(2)0.5mol CH4在氧气中燃烧生成CO2和液态水,放出445kJ热量,则1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,所以热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol.
(3)A、氯仿(CHCl3)中H原子不具有8电子结构.空间结构是四面体但不对称,是极性分子;
B.N2 是单质,分子中含有3对共用电子对,N原子原子的最外层电子数是5,具有8电子结构.由非极性键结合而成的双原子分子,是非极性分子;
C.BrCl 原子间有1对共用电子对,原子的最外层电子数是7,都具有8电子结构.是由极性键结合而成的双原子分子.是极性分子;
D.NH2D 中H原子不具有8电子结构. 是三角锥型,不对称,是极性分子;
E.CH4 中H原子不具有8电子结构.空间结构是正四面体对称结构,是非极性分子;
F.H2O 中H原子不具有8电子结构.空间结构是角型不对称结构,是极性分子;
G.CO2 中C原子、O原子都满足“最外层电子数+|化合价|=8”的,具有8电子结构.是直线对称型结构,是非极性分子;
H.He是单质,原子的最外层电子数是2,不具有8电子结构.是单原子分子,是非极性分子.
所以满足最外层8电子结构的单质是B,是非极性分子的化合物的是EG.
故答案为:B; E G
(4)①根据氧化还原反应配平,该反应为3 C+2 K2Cr2O7+8 H2SO4(稀)=3 CO2+2 K2SO4+2 Cr2(SO4)3+8 H2O.
故答案为:3; 2; 8;3;2; 2;8
②K2Cr2O7中的Cr元素化合价由+6价降至+3价,所以K2Cr2O7是氧化剂;C元素化合价由0价升至CO2中+4价,被氧化,被氧化的元素所对应的产物是CO2.
故答案为:K2Cr2O7;CO2
③反应前后硫酸所含元素化合价未变,硫酸根的数目相等,故硫酸起酸的作用.
故选:A
点评:本题综合性较大,考查内容涉及化学键、分子极性、热化学方程式、氧化还原反应等,难度中等.

练习册系列答案
相关题目
 CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:
 CH3OH(g)
CH3OH(g)
 CH3OH(g)
CH3OH(g)