摘要:13.一个总体共有100个个体.随机编号0.1.2.-.99.按从小到大的编号顺序平均分成10个小组.组号依次为1.2.3.-.10.现用系统抽样方法抽取一个容量为10的样本.规定如果在第1组随机抽取的号码为m.那么在第k组中抽取的号码个位数字与m+k的个位数字相同.若m=4.则在第6组中抽取的号码是
网址:http://m.1010jiajiao.com/timu3_id_404284[举报]
某共价化合物含碳、氢、氮三种元素,分子中共有四个氮原子,且都位于正四面体的顶点,每两个氮原子间都有一个碳原子.已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为( )
| A、CH8N4 | B、C4H8N4 | C、C6H10N4 | D、C6H12N4 |
(1)0.5molO3中含有的分子数是
(2)将4gNaOH溶于
(3)将下列残缺的离子方程式补充完整,然后写出一个相应的化学方程式.
Cu(OH)2+
(4)下列物质能导电的是
①水银 ②烧碱 ③干冰 ④氯化钠晶体 ⑤盐酸溶液 ⑥蔗糖
(5)在标准状况下,1.7g氨气所占的体积为
查看习题详情和答案>>
0.5NA
0.5NA
个,原子数是1.5NA
1.5NA
个,质子数是12NA
12NA
个.(2)将4gNaOH溶于
180
180
克水中,才能使每100个H2O分子溶有一个Na+.(3)将下列残缺的离子方程式补充完整,然后写出一个相应的化学方程式.
Cu(OH)2+
2H+
2H+
=Cu2++2H2O
2H2O
(4)下列物质能导电的是
①⑤
①⑤
,属于电解质的是②④
②④
,属于非电解质的是③⑥
③⑥
.①水银 ②烧碱 ③干冰 ④氯化钠晶体 ⑤盐酸溶液 ⑥蔗糖
(5)在标准状况下,1.7g氨气所占的体积为
2.24
2.24
L,它与标准状况下3.36
3.36
L的硫化氢(H2S)含有相同数目的氢原子.元素周期表共有
查看习题详情和答案>>
七
七
个周期,其中1、2、3周期称为短周期
短周期
;第五周期含有18
18
种元素;元素周期表中共有18个纵列,其中第8、9、10三个纵列称为ⅤⅢ族
ⅤⅢ族
,第18列由稀有气体元素组成,这一族称作0族;其余14列,每个纵列为一个族,有主族
主族
和副族
副族
之分.(2011?宝鸡一模)化学选修5-有机化学基础
已知氢化阿托醛D结构简式为 是一种重要的化工原料.有关它的反应如下图所示.
是一种重要的化工原料.有关它的反应如下图所示.

请回答下列问题:
(1)氢化阿托醛的分子式为
(2)由B生成G、由C生成G的反应条件分别是
(3)由A生成B、由G生成H的反应类型分别是
(4)B为一取代芳烃,由B生成C的化学方程式为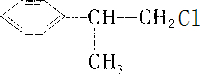 +H2O
+H2O
 +HCl
+HCl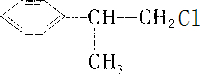 +H2O
+H2O
 +HCl.
+HCl.
(5)C和E生成F的化学方程式为 +
+
 +H2O
+H2O +
+
 +H2O.
+H2O.
(6)在E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体共有 、
、
 、
、 (填结构简式).
(填结构简式).
查看习题详情和答案>>
已知氢化阿托醛D结构简式为
 是一种重要的化工原料.有关它的反应如下图所示.
是一种重要的化工原料.有关它的反应如下图所示.
请回答下列问题:
(1)氢化阿托醛的分子式为
C9H10O
C9H10O
,其被氧化后的含氧官能团的名称是羧基
羧基
.(2)由B生成G、由C生成G的反应条件分别是
NaOH/醇溶液
NaOH/醇溶液
、浓硫酸/△
浓硫酸/△
.(3)由A生成B、由G生成H的反应类型分别是
取代反应、加成反应
取代反应、加成反应
.(4)B为一取代芳烃,由B生成C的化学方程式为
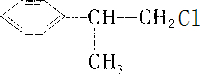 +H2O
+H2O| NaOH |
 +HCl
+HCl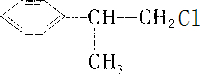 +H2O
+H2O| NaOH |
 +HCl
+HCl(5)C和E生成F的化学方程式为
 +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O +
+
| 浓硫酸 |
| △ |
 +H2O
+H2O(6)在E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体共有
5
5
个,写出其中的两种 、
、
 、
、
(2011?德州一模)已知A、B、D、E、F五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子s轨道电子数是p轨道电子数的2倍;D原子中未成对电子数是同周期元素中最多的;E原子L层上有2对成对电子;F原子核外共有21个电子.
请回答下列问题:
(1)写出F元素基态原子的电子排布式为
F单质的晶体具有体心立方结构,则在该晶体的一个晶胞中,含有的原子数是
(2)B、D、E三种元素的第一电离能最大的是
(3)B与D原子结合形成的晶体目前是世界上最硬的材料,晶体结构类似金刚石,但硬度超过了金刚石,其原因是
该晶体中任一原子的配位数比E单质晶体中分子的配位数要
查看习题详情和答案>>
请回答下列问题:
(1)写出F元素基态原子的电子排布式为
1s22s22p63s23p63d14s2
1s22s22p63s23p63d14s2
.F单质的晶体具有体心立方结构,则在该晶体的一个晶胞中,含有的原子数是
2
2
.(2)B、D、E三种元素的第一电离能最大的是
N
N
(填元素符号),(3)B与D原子结合形成的晶体目前是世界上最硬的材料,晶体结构类似金刚石,但硬度超过了金刚石,其原因是
氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大
氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大
.该晶体中任一原子的配位数比E单质晶体中分子的配位数要
小
小
.