题目内容
(2011?宝鸡一模)化学选修5-有机化学基础
已知氢化阿托醛D结构简式为 是一种重要的化工原料.有关它的反应如下图所示.
是一种重要的化工原料.有关它的反应如下图所示.

请回答下列问题:
(1)氢化阿托醛的分子式为
(2)由B生成G、由C生成G的反应条件分别是
(3)由A生成B、由G生成H的反应类型分别是
(4)B为一取代芳烃,由B生成C的化学方程式为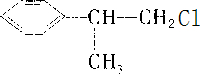 +H2O
+H2O
 +HCl
+HCl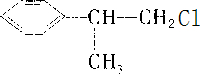 +H2O
+H2O
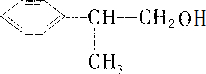 +HCl.
+HCl.
(5)C和E生成F的化学方程式为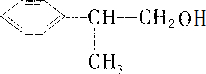 +
+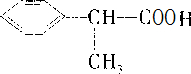
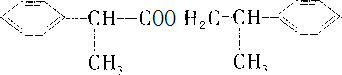 +H2O
+H2O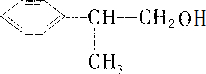 +
+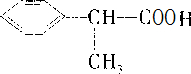
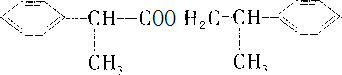 +H2O.
+H2O.
(6)在E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体共有 、
、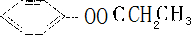
 、
、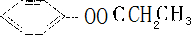 (填结构简式).
(填结构简式).
已知氢化阿托醛D结构简式为
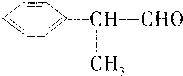 是一种重要的化工原料.有关它的反应如下图所示.
是一种重要的化工原料.有关它的反应如下图所示.
请回答下列问题:
(1)氢化阿托醛的分子式为
C9H10O
C9H10O
,其被氧化后的含氧官能团的名称是羧基
羧基
.(2)由B生成G、由C生成G的反应条件分别是
NaOH/醇溶液
NaOH/醇溶液
、浓硫酸/△
浓硫酸/△
.(3)由A生成B、由G生成H的反应类型分别是
取代反应、加成反应
取代反应、加成反应
.(4)B为一取代芳烃,由B生成C的化学方程式为
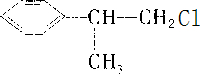 +H2O
+H2O| NaOH |
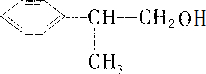 +HCl
+HCl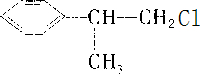 +H2O
+H2O| NaOH |
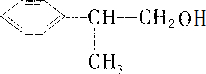 +HCl
+HCl(5)C和E生成F的化学方程式为
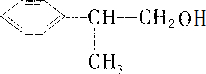 +
+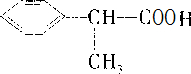
| 浓硫酸 |
| △ |
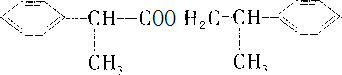 +H2O
+H2O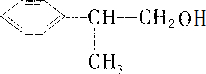 +
+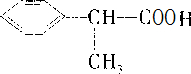
| 浓硫酸 |
| △ |
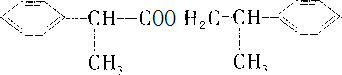 +H2O
+H2O(6)在E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体共有
5
5
个,写出其中的两种 、
、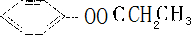
 、
、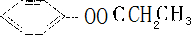
分析:D结构简式为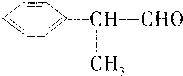 ,则C→D发生催化氧化,所以C为
,则C→D发生催化氧化,所以C为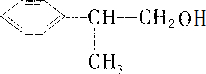 ,A→B发生取代反应,B→C为卤代烃的水解,所以A为
,A→B发生取代反应,B→C为卤代烃的水解,所以A为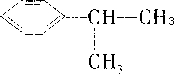 ,B为
,B为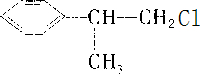 ,D与新制的氢氧化铜悬浊液反应生成E,则E为
,D与新制的氢氧化铜悬浊液反应生成E,则E为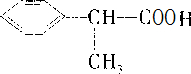 ,C与E发生酯化反应生成F,F为
,C与E发生酯化反应生成F,F为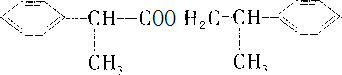 ,B、C均可发生消去反应生成G,G为
,B、C均可发生消去反应生成G,G为 ,G与溴发生加成反应生成H,H为
,G与溴发生加成反应生成H,H为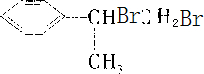 ,然后结合有机物的结构及性质来解答.
,然后结合有机物的结构及性质来解答.
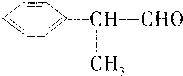 ,则C→D发生催化氧化,所以C为
,则C→D发生催化氧化,所以C为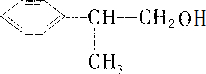 ,A→B发生取代反应,B→C为卤代烃的水解,所以A为
,A→B发生取代反应,B→C为卤代烃的水解,所以A为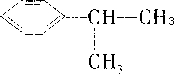 ,B为
,B为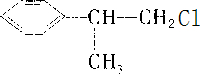 ,D与新制的氢氧化铜悬浊液反应生成E,则E为
,D与新制的氢氧化铜悬浊液反应生成E,则E为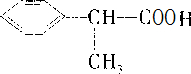 ,C与E发生酯化反应生成F,F为
,C与E发生酯化反应生成F,F为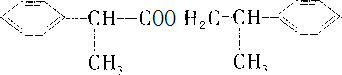 ,B、C均可发生消去反应生成G,G为
,B、C均可发生消去反应生成G,G为 ,G与溴发生加成反应生成H,H为
,G与溴发生加成反应生成H,H为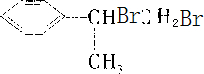 ,然后结合有机物的结构及性质来解答.
,然后结合有机物的结构及性质来解答.解答:解:D结构简式为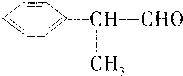 ,则C→D发生催化氧化,所以C为
,则C→D发生催化氧化,所以C为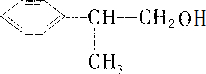 ,A→B发生取代反应,B→C为卤代烃的水解,所以A为
,A→B发生取代反应,B→C为卤代烃的水解,所以A为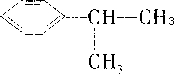 ,B为
,B为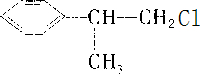 ,D与新制的氢氧化铜悬浊液反应生成E,则E为
,D与新制的氢氧化铜悬浊液反应生成E,则E为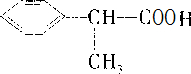 ,C与E发生酯化反应生成F,F为
,C与E发生酯化反应生成F,F为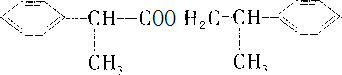 ,B、C均可发生消去反应生成G,G为
,B、C均可发生消去反应生成G,G为 ,G与溴发生加成反应生成H,H为
,G与溴发生加成反应生成H,H为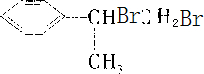 ,
,
(1)D的分子式为C9H10O,D被氧化生成E,其含氧官能团为羧基,故答案为:C9H10O;羧基;
(2)B为卤代烃,在NaOH/醇溶液中发生消去反应生成G,C为醇,在浓硫酸/△条件下发生消去反应生成G,故答案为:NaOH/醇溶液;浓硫酸/△;
(3)A→B为取代反应,G→H为加成反应,故答案为:取代反应、加成反应;
(4)B为一取代芳烃,由B生成C的化学方程式为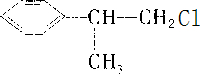 +H2O
+H2O
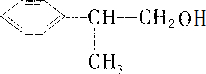 +HCl,
+HCl,
故答案为: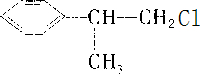 +H2O
+H2O
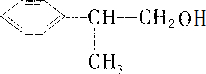 +HCl;
+HCl;
(5)C与E发生酯化反应生成F,该反应为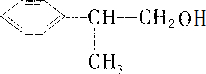 +
+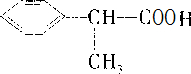
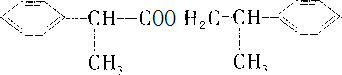 +H2O,
+H2O,
故答案为: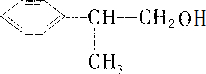 +
+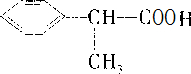
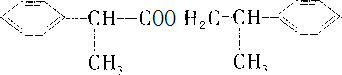 +H2O;
+H2O;
(6)E为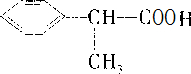 E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体有
E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体有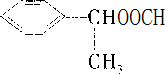 、
、 、
、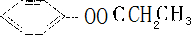 、
、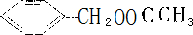 、
、 ,共5种,故答案为:5;
,共5种,故答案为:5; 、
、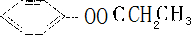 .
.
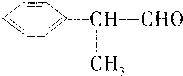 ,则C→D发生催化氧化,所以C为
,则C→D发生催化氧化,所以C为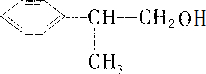 ,A→B发生取代反应,B→C为卤代烃的水解,所以A为
,A→B发生取代反应,B→C为卤代烃的水解,所以A为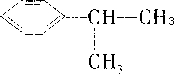 ,B为
,B为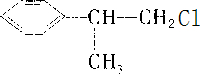 ,D与新制的氢氧化铜悬浊液反应生成E,则E为
,D与新制的氢氧化铜悬浊液反应生成E,则E为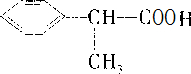 ,C与E发生酯化反应生成F,F为
,C与E发生酯化反应生成F,F为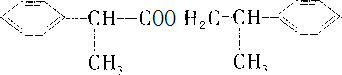 ,B、C均可发生消去反应生成G,G为
,B、C均可发生消去反应生成G,G为 ,G与溴发生加成反应生成H,H为
,G与溴发生加成反应生成H,H为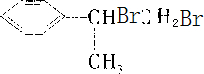 ,
,(1)D的分子式为C9H10O,D被氧化生成E,其含氧官能团为羧基,故答案为:C9H10O;羧基;
(2)B为卤代烃,在NaOH/醇溶液中发生消去反应生成G,C为醇,在浓硫酸/△条件下发生消去反应生成G,故答案为:NaOH/醇溶液;浓硫酸/△;
(3)A→B为取代反应,G→H为加成反应,故答案为:取代反应、加成反应;
(4)B为一取代芳烃,由B生成C的化学方程式为
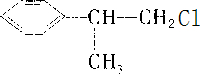 +H2O
+H2O| NaOH |
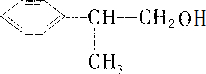 +HCl,
+HCl,故答案为:
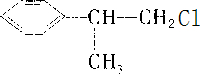 +H2O
+H2O| NaOH |
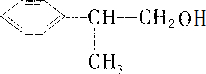 +HCl;
+HCl;(5)C与E发生酯化反应生成F,该反应为
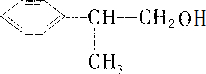 +
+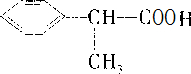
| 浓硫酸 |
| △ |
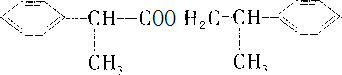 +H2O,
+H2O,故答案为:
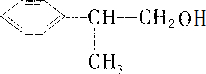 +
+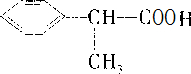
| 浓硫酸 |
| △ |
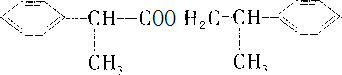 +H2O;
+H2O;(6)E为
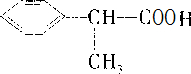 E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体有
E的同分异构体中,苯环上只有一个取代基且属于酯类的同分异构体有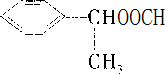 、
、 、
、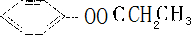 、
、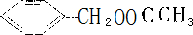 、
、 ,共5种,故答案为:5;
,共5种,故答案为:5; 、
、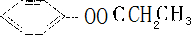 .
.点评:本题考查有机物的推断,明确转化中的反应条件及碳架结构、官能团的变化等是解答本题的关键,(6)为学生解答的易错点,注意只有一个取代基且属于酯类,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目