摘要:用铂电极电解500mlCuSO4 溶液.通电一段时间后.某一极增重0.064g(设电解时该电极上无氢气生成.且不考虑水解和溶液体积的变化).此时溶液中氢离子浓度约为( ) A 4×10-3 B 2×10-10 C 1×10-10 D 1×10-7
网址:http://m.1010jiajiao.com/timu3_id_404238[举报]
 分别回答下列问题.
分别回答下列问题.(1)从H+、Na+、Cu2+、Cl-、S
| O | 2- 4 |
①电解过程中溶液颜色变浅且水量不变
CuCl2
CuCl2
;②电解过程中电解质含量不变,水量减少
H2SO4或Na2SO4
H2SO4或Na2SO4
;③电解过程中,两极析出气体的体积比为1:1
HCl或NaCl
HCl或NaCl
.(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体在标准状况下的体积约为
0.28L
0.28L
;②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为(忽略溶液体积的变化)
0.04mol/L
0.04mol/L
;③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ;C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)△H=-2220.0kJ实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
3:1
3:1
.(3)如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是
U形管左端液面上升,右边液面下降
U形管左端液面上升,右边液面下降
,甲中正极反应为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,乙中正极反应为2H++2e-=H2↑
2H++2e-=H2↑
.用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )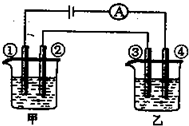
|
查看习题详情和答案>>