题目内容
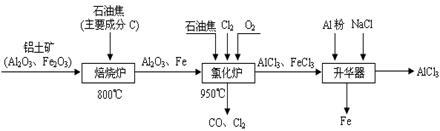
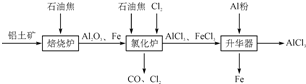
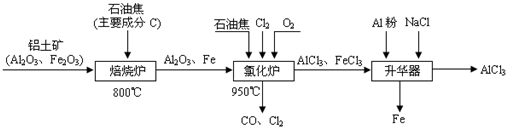
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
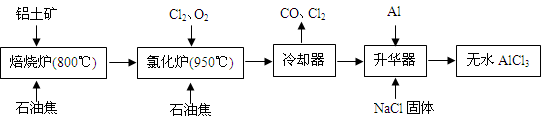
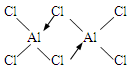
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是: 晶体,其结构式为: 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
(1)分子
(2)A12O3+3C12+3C 2
A1C13+3CO
2
A1C13+3CO
(3)SO32-+C12+H2O=SO42-+2C1-+2H+
(4)除去FeCl3
(5)1.38%(或1.4%)
【解析】
试题分析:(1)根据氯化铝的物理性质易升华确定其为分子晶体;根据所有原子最外层均达到8电子稳定结构,确定氯化铝结构式;(2)反应物是Al2O3、Cl2和C,根据流程确定产物是氯化铝和CO;(3)Na2SO3为还原剂被Cl2氧化为+6价的硫酸盐,氯被还原为-1价;(4)铝的活泼性比铁强,加入铝把FeCl3中铁置换出来,同时生成易升华的氯化铝;
(5)最后残留固体的为氧化铁,n(Fe)=2×n(Fe2O3)= 2×0.32÷160=0.004mol
W(Fe)= 0.004×56÷16.25=0.014
考点:考查工业流程中反应原理、物质结构、实验分析等有关问题。

 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式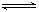 HSO3-+OH-
HSO3-+OH-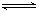 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是