网址:http://m.1010jiajiao.com/timu3_id_40316[举报]
药品:稀硫酸、浓硫酸、氧化铜,
实验装置:另有托盘天平可用,
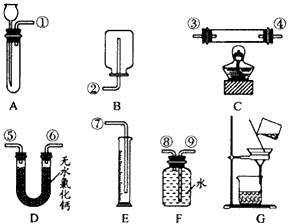
(1)你选用的药品是____。
(2)你选用的实验装置有___(填装置编号)。若需要组装,则连接的顺序是____(用装置接口处的编号表示。若不需要组装,则不填)。
(3)称取ag黄铜粉样品进行实验,实验中测定的 其他有效数据是___。
A.标准状况下,生成H2的体积bL
B.反应前仪器和药品的质量cg
C.反应后剩余固体的质量dg
D.反应后仪器和药品的质量eg
(4)计算合金中锌的质量分数____ 。
实验室有黄铜(铜和锌两种金属的混合物)粉末。某兴趣小组欲利用给出的实验仪器及试剂,测定样品中锌的质量分数。除托盘天平必用外,供选择的实验装置如图所示;除样品黄铜外,供选择的药品有:足量的浓硫酸、足量的稀硫酸、足量氧化铜

(1)你认为一定要用的药品是 。
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为 。若实验过程中称得样品质量为a g,充分反应后生成的氢气体积为b L(标准状况下),则合金中锌的质量分数为 。
(3)乙同学称取黄铜的质量a g,充分反应后剩余固体的质量为d g。他在实验中使用了上图中 装置测定样品中锌的质量分数(填序号A…)。
(4)丙同学实验中只使用了A装置,他需要测得的实验数据有 和 。
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,并使用了足量的稀硫酸和氧化铜两种试剂,除称量黄铜的质量外,还称量了C装置反应前、后仪器和药品的质量,但他并不能准确测定出合金中锌的质量分数,原因是 。
查看习题详情和答案>>甲:①白色结晶状粉末,受热可缓缓分解;
②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;
③遇酸及酸性药物则产生二氧化碳;
④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;
②凝胶本身覆盖于溃疡面上,具有保护作用;
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是____________(填化学式);乙中含有的主要化学成份是
____________(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:____________________________。
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁改写成氧化物形式为:_________________________。写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式_______________________________。
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO)。现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50mL3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
则该药剂中三种主要成分的物质的量之比为n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=_________。
胃酸过多是常见的胃病.下面是甲、乙两种常见胃药的说明摘要.
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险.
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中.
(1)请你推测,甲中含有的主要化学成份是________(填化学式);乙中含有的主要化学成份是________(填化学式).
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:________.
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久.把三硅酸镁改写成氧化物形式为:________.
写出它中和胃酸(胃酸的主要成分是HCl)的化学方程式________.
(4)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO).现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50 mL 3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224 mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4 g.
则该药剂中三种主要成分的物质的量之比为n(MgCO3)∶n(Mg(OH)2)∶n(Al(OH)3)=________.
实验是进行化学研究的重要手段之一.请回答下列问题:
(1)下列实验操作,错误的是________(填写序号).
a.用纸槽往试管里装粉末状药品时,试管应先横放再直立
b.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450 mL 0.1 mol·L-1 NaOH溶液和500 mL 0.5 mol·L-1硫酸溶液.请回答下
列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有________.

②在容量瓶的使用方法中,下列操作正确的是________(填写序号).
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水.
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
③配制450 mL 0.1 mol·L-1 NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为________g.
b.称量氢氧化钠固体.
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切.
上述步骤的正确操作顺序为________(用序号表示).
④根据计算得知,需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL,如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好.