摘要:1.D 2.CD 3.AB 讲析:1.量筒是无零刻度的计量仪器.其刻度计量由下而上逐渐增大.图中的10mL量筒分度值是0.2mL.因此(1)的正确答案为3.2mL.滴定管的精度比量筒高的多.它是有零刻度的计量仪器.其刻度由下而上逐渐减小.可量至0.01mL.滴定管下端无刻度线部分也充满溶液.2.滴定时的正确操作应为:左手控制滴定管活塞.右手握持锥形瓶.边滴边振荡.眼睛注视锥形瓶内溶液颜色变化.称量时.托盘天平的两盘中应放质量相等的称量纸.然后“左物右砝 进行称量.3.氢氟酸腐蚀玻璃.不能保存在玻璃瓶中,浓HNO3易分解.应保存在均应保存棕色瓶中.汽油.高锰酸钾会引起橡皮的老化.
网址:http://m.1010jiajiao.com/timu3_id_40292[举报]
现有100g5.3%的碳酸钠溶液和100g2.74%的稀盐酸:(1)将碳酸钠溶液缓慢滴入盐酸中,(2)将稀盐酸缓慢滴入碳酸钠溶液中,则两种操作所产生的气体质量关系为( )
| A、均是1.65g | B、均是1.49g | C、(1)>(2) | D、(2)>(1) |
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
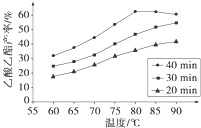
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=
(12分)(1)有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体。A完全燃烧后生成二氧化碳与水物质的量之比是2:1;B的分子量是A的三倍;C既不能使酸性高锰酸钾溶液褪色也不能使溴水褪色,但在光照条件下最多可与六倍体积氯气发生反应;燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,在催化剂作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。试推断有机物A、B、C、D,分别写出结构简式:
A:______________ B:_____________
C:______________ D:___________
(2)相对分子质量为72的某烃,其分子式是___________,若此有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个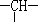 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)