摘要:27.某温度下.实验室利用MnO2和浓盐酸制得的一定量气体全部通入1L0.21mol/L NaOH溶液中.反应完毕.测得溶液中OH-离子的浓度为0.01mol/L.且生成的NaC1O和NaC1O3的物质的量之比为1:3.则: (1)参加反应的NaOH的物质的量为 mol. (2)被氧化的氯气和被还原的氯气的物质的量分别为 mol 和mol. (3)实验室中至少消耗MnO2 克.
网址:http://m.1010jiajiao.com/timu3_id_402272[举报]
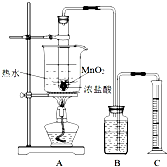 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
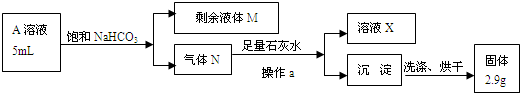
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为
某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
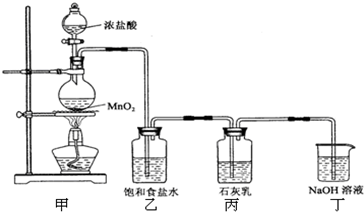
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是
(3)乙装置的作用是
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:
查看习题详情和答案>>
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:

请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
;
| ||
(3)乙装置的作用是
除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
,丁装置的作用是进行尾气处理
进行尾气处理
.(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
7.15
7.15
g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
| ||
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:
将丙装置置于装有冷水的容器中
将丙装置置于装有冷水的容器中
.某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
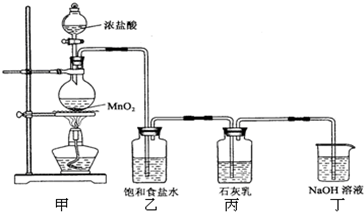
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是______;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是______;
(3)乙装置的作用是______,丁装置的作用是______.
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.
查看习题详情和答案>>
某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
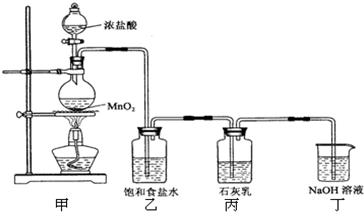
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是______;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是______;
(3)乙装置的作用是______,丁装置的作用是______.
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.
查看习题详情和答案>>
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:

请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是______;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是______;
(3)乙装置的作用是______,丁装置的作用是______.
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
| ||
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.
某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
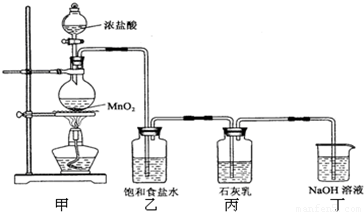
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是 ;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是 ;
(3)乙装置的作用是 ,丁装置的作用是 .
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2 g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法: . 查看习题详情和答案>>
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:

请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是 ;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是 ;
(3)乙装置的作用是 ,丁装置的作用是 .
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2 g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法: . 查看习题详情和答案>>