题目内容
某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
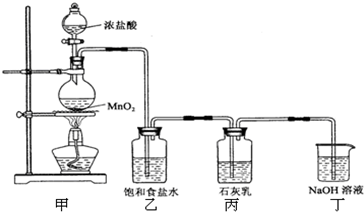
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是
(3)乙装置的作用是
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:

请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
;
| ||
(3)乙装置的作用是
除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
,丁装置的作用是进行尾气处理
进行尾气处理
.(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
7.15
7.15
g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
| ||
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:
将丙装置置于装有冷水的容器中
将丙装置置于装有冷水的容器中
.分析:(1)实验室制取氯气是用浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,结合配平写出;
(2)工业上电解饱和食盐水来制备氯气,是氯化钠和水在通电条件下电解反应生成氢氧化钠、氯气和氢气;
(3)饱和食盐水的主要作用是除去氯气中的氯化氢气体;,氢氧化钠溶液在装置末,主要是尾气处理,防止有毒气体氯气污染环境;
(4)依据MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,结合定量关系计算理论值;
(5)依据(4)中 信息反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生反应,6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O;
(2)工业上电解饱和食盐水来制备氯气,是氯化钠和水在通电条件下电解反应生成氢氧化钠、氯气和氢气;
(3)饱和食盐水的主要作用是除去氯气中的氯化氢气体;,氢氧化钠溶液在装置末,主要是尾气处理,防止有毒气体氯气污染环境;
(4)依据MnO2+4HCl(浓)
| ||
(5)依据(4)中 信息反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生反应,6Cl2+6Ca(OH)2
| ||
解答:解:(1)实验室制取氯气是用浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)工业上电解饱和食盐水来制备氯气,是氯化钠和水在通电条件下电解反应生成氢氧化钠、氯气和氢气,反应的化学方程式为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH;
故答案为:2NaCl+2H2O
H2↑+Cl2↑+2NaOH;
(3)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,进行尾气处理;
故答案为:除去Cl2中混有的HCl气体;进行尾气处理;
(4)足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2;可以依据反应MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol;
2MnO2~Ca(ClO)2
2 1
0.1mol 0.05mol
所以理论上最多可制得Ca(ClO)2 质量=0.05mol×143g/mol=7.15g;故答案为:7.15;
(5)依据(4)中 信息反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生反应,6Cl2+6Ca(OH)2
5CaCl2+Ca(ClO3)2+6H2O;
故答案为:将丙装置置于装有冷水的容器中;
MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)工业上电解饱和食盐水来制备氯气,是氯化钠和水在通电条件下电解反应生成氢氧化钠、氯气和氢气,反应的化学方程式为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(3)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,进行尾气处理;
故答案为:除去Cl2中混有的HCl气体;进行尾气处理;
(4)足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2;可以依据反应MnO2+4HCl(浓)
| ||
2MnO2~Ca(ClO)2
2 1
0.1mol 0.05mol
所以理论上最多可制得Ca(ClO)2 质量=0.05mol×143g/mol=7.15g;故答案为:7.15;
(5)依据(4)中 信息反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生反应,6Cl2+6Ca(OH)2
| ||
故答案为:将丙装置置于装有冷水的容器中;
点评:本题考查了氯气的实验是制备和工业制备,实验过程注意问题,反应化学方程式的书写,漂白粉的制取条件,化学方程式的计算应用,题目难度中等.

练习册系列答案
相关题目






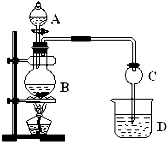 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题: