摘要:25℃时.在0.10mol/L的氨水中逐滴加入同浓度的盐酸直至过量.回答下列问题: (1)经测定.25℃时.在0.1 L 0.1mol/L的氨水溶液中c(OH-)=1.3×10-3mol/L.此时一水合氨的电离平衡常数表达式为 .若向该氨水中滴加少量酚酞试液.溶液呈 色,若将上述浓度的氨水稀释10倍.则c(OH-) 1.3×10-4mol/L. (2)当溶液PH=7时.溶液中c(NH4+) c(Cl-).当盐酸和 氨水溶液恰好中和时.溶液丰c(H+) c(OH-) . (3)在上述实验中.该溶液PH变化趋势为 ,25℃时.在浓度均为0.1mol/L的氨水和盐酸中.由水电离出来的c(H+)之比约为 . 选考部分 以下是选答题.其中18.19.30.21题为模块题.22.23.24.25题为模块题.26.27.28.29.30为模块题.考生只能从三个模块中任选一个作答.不得跨模块答题.否则只能以所答的第一个模块计分. 模块 18-20为选择题.每小题只有一个正确选项.每小题3分
网址:http://m.1010jiajiao.com/timu3_id_40169[举报]
25℃时,在0.1 mol·L-1的下列溶液中,微粒的物质的量浓度关系正确的是
| A.NH4Cl溶液中:c(NH4+)>c(Cl—)>c(H+)>c(OH-) |
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO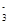 )>c(SO )>c(SO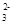 )>c(H2SO3) )>c(H2SO3) |
| C.CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
D.Na2CO3溶液中:2c(Na+)=c(CO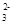 )+ c(HCO )+ c(HCO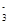 )+c(H2CO3) )+c(H2CO3) |