题目内容
25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.01 mol的HA电离成离子。求该温度下HA的电离常数。
【答案】
k=2.22×10-3
【解析】
试题分析:该溶液中A-、H+平衡浓度为0.01
mol/0.5 L="0.02" mol·L-1,据电离方程式HA H++A-推知HA分子的平衡浓度为0.2 mol·L-1-0.02
mol·L-1="0.18" mol·L-1。HA的电离常数k=
H++A-推知HA分子的平衡浓度为0.2 mol·L-1-0.02
mol·L-1="0.18" mol·L-1。HA的电离常数k=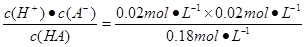 =2.22×10-3。
=2.22×10-3。
考点:考查弱电解质电离常数的有关计算
点评:该题是中等难度的试题,试题基础性强,主要是考查学生对电离平衡常数的了解、掌握情况,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的规范答题能力。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目