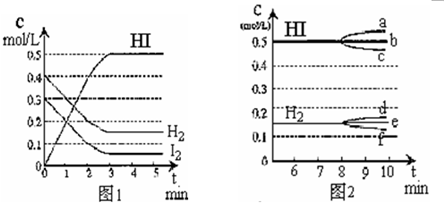
题目内容
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g),△H<0反应中各物质的浓度随时间的变化情况如图1所示.试回答下列问题:
(1)该反应的化学平衡常数的表达式为
.
(2)根据图1数据,反应开始至达到平衡时,反应的平均速率v(HI)为
(3)反应达到平衡后,第8min时:①若升高温度,化学平衡常数K
②若加入I2,H2浓度的变化正确的是
(4)反应达到平衡后,第8min时,若把容器的容积扩大一倍,请在图3中画出第8min后HI浓度的变化情况.

(1)该反应的化学平衡常数的表达式为
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
(2)根据图1数据,反应开始至达到平衡时,反应的平均速率v(HI)为
0.167mol/(L?min)
0.167mol/(L?min)
.(3)反应达到平衡后,第8min时:①若升高温度,化学平衡常数K
减小
减小
(填“增大”、“减小”或“不变”),HI的浓度变化正确的是c
c
(用图2中的a~c的编号回答).②若加入I2,H2浓度的变化正确的是
f
f
(用图2中的d~f的编号回答).(4)反应达到平衡后,第8min时,若把容器的容积扩大一倍,请在图3中画出第8min后HI浓度的变化情况.
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)根据v=
计算平均速率v(HI);
(3)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少;
(4)反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小.
(2)根据v=
| △c |
| △t |
(3)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少;
(4)反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小.
解答:解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=
,故答案为:K=
;
(2)平均速率v(HI)=
=0.167mol?L-1?min-1,故答案为:0.167mol;
(3)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减少;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(4)H2(g)+I2(g)?2HI(g),反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图: ,故答案为:
,故答案为: .
.
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
(2)平均速率v(HI)=
| 0.5mol/L |
| 3min |
(3)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减少;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(4)H2(g)+I2(g)?2HI(g),反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图:
 ,故答案为:
,故答案为: .
.点评:本题主要考查了平衡常数、化学平衡移动以及化学反应速率的计算,难度不大,需要注意的是:化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,反之则减少.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
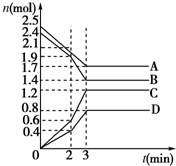 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示: