摘要:18.下列说法中正确的是 ( ) A.核外电子排布完全相同的两种微粒.其化学性质一定相同 B.具有固定熔点或沸点的物质一定是纯净物 C.一种离子和一种分子的质子数和电子数不可能同时相等 D.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
网址:http://m.1010jiajiao.com/timu3_id_401489[举报]
|
下列说法中,正确的是 | |
A. |
核外电子排布完全相同的两种微粒,其化学性质一定相同 |
B. |
原子最外层电子数大于4的元素一定是非金属元素 |
C. |
元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
D. |
同周期的主族元素从左到右,元素的非金属性逐渐增强,气态氢化物的稳定性逐渐增强 |
I.下列描述中正确的是
A.CS2为V形的极性分子 B.Cl0-3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对 D.SiF4和SO2-3 的中心原子均为sp3杂化
Ⅱ.下列说法中错误的是:
A.SO2、SO3都是极性分子
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
Ⅲ.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: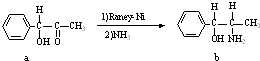
化合物b中进行sp3杂化的原子有: .
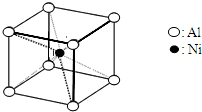
(3)一种铝镍合金的结构如图,与其结构相似的化合物是: (选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石).
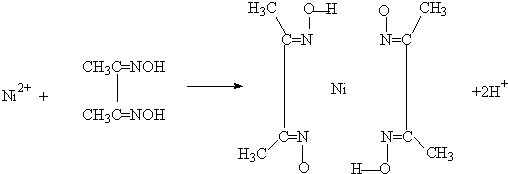
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为: .
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).
 查看习题详情和答案>>
查看习题详情和答案>>
A.CS2为V形的极性分子 B.Cl0-3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对 D.SiF4和SO2-3 的中心原子均为sp3杂化
Ⅱ.下列说法中错误的是:
A.SO2、SO3都是极性分子
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
Ⅲ.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al
(2)雷尼镍催化的一实例为:

化合物b中进行sp3杂化的原子有:
(3)一种铝镍合金的结构如图,与其结构相似的化合物是:

(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为:
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).
 查看习题详情和答案>>
查看习题详情和答案>>
下列说法正确的是
[ ]
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.难失电子的原子,一定具有强氧化性
C.离子化合物和共价化合物中都可能含有非极性键
D.共价化合物溶于水电离过程中,共价键被破坏
查看习题详情和答案>>