网址:http://m.1010jiajiao.com/timu3_id_401091[举报]
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”) 184.4 kJ。
②已知

1mol N—H键断裂吸收的能量等于 kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)
 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①该反应的
 0(填“>’或“<”)。
0(填“>’或“<”)。②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液) 。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式 。
Na2CO3水溶液呈碱性,其原因是
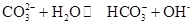 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。(1)“神舟”六号起飞时,可以看到一级火箭的中部冒出红棕色的气体,这是为了保证贮箱安全由保险活门自动开启所排出的部分高压氧化剂变化而来的,逸出的红棕色气体是_________,产生该气体的化学反应方程式为__________________。
(2)当有1 mol偏二甲肼燃烧时,转移电子的物质的量为_________。
(3)有的运载火箭用肼(N2H4)作燃料和二氧化氮反应,已知:
N2(g)+2O2(g)====2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式,正确的是( )
A.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(l);ΔH=-1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(g);ΔH=-1 000.3 kJ·mol-1
C.N2H4(g)+NO2(g)====3/2N2(g)+2H2O(l):ΔH=-1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(g);ΔH=-1 135.7 kJ·mol-1
这个反应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是_____________________________________________________________________。
(4)通常情况下四氧化二氮气体和二氧化氮气体可相互转化:N2O4(g)(无色)![]() 2NO2(g)(红棕色);ΔH>0。已知二氧化氮有较强的氧化性,则下列说法错误的是( )
2NO2(g)(红棕色);ΔH>0。已知二氧化氮有较强的氧化性,则下列说法错误的是( )
A.N2O4和NO2互为同素异形体
B.气态时,1 mol N2O4可完全分解成2 mol NO2
C.鉴别NO2(g)和溴蒸气可选用淀粉—碘化钾溶液
D.N2O4和NO2都是硝酸的酸酐
查看习题详情和答案>>(1)单质A的燃烧热大,可作燃料.已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了
| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
(3)超导材料在节能、储能方面的应用.如图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是

能源、可划分为一级能源和二级能源。自然界中以现成形式提供的能源,击。煤、石油、天然气称为一级能源需依靠其他能源的能量间接制取的能源称为二级能源。煤、石油、天然气等是多年来大规模使用的能源,称为常规能源,属于不可再生的化石能源。一些著名的地质专家预测,石油产量最早可能在2010年,最迟在2037年达到顶峰。此后就会不可逆转地下降,而石油和天然气的价格将大幅上升,且难以回落。
煤、石油、天然气等化石燃料燃烧后会放出多种污染大气的化学物质以及二氧化碳等温室气体,而氢燃料电池源源不断地提供能量的同时排出的只有水。
美国加州理工学院的研究员在美国《科学》上撰文指出,氢燃料系统未必对环境完全无害。氢比空气轻得多,很容易向空中运动。研究员们估计完全使用氢燃料将导致进入大气同温层的氢分子增加到目前的3倍。同温层距地面15-40km,包含臭氧层,氢分子进入同温层会被氧化成水。
发展氢燃料系统的主要提倡者杰里米?里夫金说:“当转而利用一种新能源的时候,你必然设想它可能产生一些环境影响,但是氢作为化石燃料的替代物,依然是我们未来的希望。”
发展氢能源需要解决如何廉价地制备大量氢气,以及如何安全贮存、运输氢气等问题。从化石原料制取氢气,已经有比较成熟的技术及工业装置,并在不断研究改进之中,所制得的氢气主要作为化工原料,如合成氨、合成甲醇及油品等。但从化石原料制取氢气的过程必然会放出二氧化碳,因此不能解决温室气体的排放问题。非化工原料制氢主要是指从含氢物质制取氢气,其中水电解制氢技术已成熟并有工业生产装置,但电能消耗较大(每立方米氢气耗电约4~5kw-h),目前尚受到一定的限制。但从水中制氢是理想的制氢方法。
【思考】阅读以上文摘,并注意带有下划线的文字,完成下列填空。
(1)理想的制氢方法是 ,此过程是 (填写“释放”或“消耗‘)能量的过程。氢气是一种高效而又没有污染的 级能源。
(2)水电解制氢反应的化学方程式是 。
(3)关于用水制取氢气,以下研究方向不正确的是
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找特殊化学物质,用于开发廉价能源,以分解水获得氢能源
(4)作为能源,氢气具有其他能源所不具备的优点。第一,燃烧时放出的热量多,放出的热量约为同质量汽油的3倍。第二 。第三最大的优点是 。氢气的重量轻、密度小,便于运送和携带,容易储藏,与难储存的电相比,优越性更为显著。
查看习题详情和答案>>