摘要:2.(1)溴水.Na2SO3溶液,溴水褪色,Br2+SO+H2O 2H++2Br-+SO (2)Na2S溶液.Na2SO3溶液.稀硫酸,出现浑浊, 3S↓+3H2O
网址:http://m.1010jiajiao.com/timu3_id_400809[举报]
将一定体积的空气通入吸收剂,并测定其电导的变化,这种方法可以测定空气中污染物的含量.如测定硫化氢,用CuSO4溶液吸收,可测定很大浓度范围的硫化氢,但电导变化不大;用溴水吸收,仅适用于低浓度范围,但有很高的灵敏度.现要兼顾吸收容量和灵敏度,测定空气中Cl2的含量,则最好选用的吸收剂是
- A.KI溶液
- B.溴水
- C.Na2SO3溶液
- D.NaOH溶液
Na2SO3是抗氧剂.向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡溶液变为无色.
(1)SO2是大气污染物,是形成 的因素之一,实验室用亚硫酸钠固体与一定浓度的硫酸溶液反应制备SO2气体,写出该反应的离子反应方程式 .尾气通入过量NaOH溶液可得到烧碱和Na2SO3的混合溶液,该反应的化学反应方程式为 .
(2)碱性条件下Br2与Na2SO3溶液反应的离子方程式为 .
(3)硅酸钠溶液俗称水玻璃.取少量硅酸钠溶液于试管中,通入过量的SO2,得到沉淀物.写出该反应的离子方程式: .
(4)CO2气体中含有少量SO2气体,要除去SO2杂质,将混合气体通入 试剂,其反应的离子方程式: .
(5)为了探究氨还原性,某研究小组用氨和CuO在加热条件下反应,产物中得到一种红色固体和一种气体单质.写出反应化学方程式 .
查看习题详情和答案>>
(1)SO2是大气污染物,是形成
(2)碱性条件下Br2与Na2SO3溶液反应的离子方程式为
(3)硅酸钠溶液俗称水玻璃.取少量硅酸钠溶液于试管中,通入过量的SO2,得到沉淀物.写出该反应的离子方程式:
(4)CO2气体中含有少量SO2气体,要除去SO2杂质,将混合气体通入
(5)为了探究氨还原性,某研究小组用氨和CuO在加热条件下反应,产物中得到一种红色固体和一种气体单质.写出反应化学方程式
亚硫酸钠中有+4价的硫,它既有氧化性又有还原性.现有试剂:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、烧碱溶液、氨水.
①要证明Na2SO3具有还原性,应选用的试剂有
②要证明Na2SO3具有氧化性,应选用的试剂有
查看习题详情和答案>>
①要证明Na2SO3具有还原性,应选用的试剂有
溴水
溴水
;现象是溴水褪色
溴水褪色
.②要证明Na2SO3具有氧化性,应选用的试剂有
Na2S溶液
Na2S溶液
、稀硫酸.现象是生成浅黄色沉淀
生成浅黄色沉淀
.
硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题.
(1)将H2S气体通入FeCl3溶液中,现象是 ;反应的离子方程式是 .
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
已知:电离平衡常数:H2S K1=1.3×10-7;K2=7.1×10-15
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
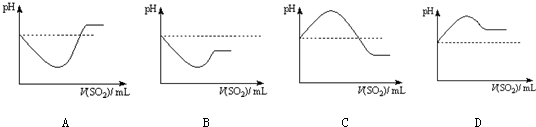
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 (选填编号).
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有 ,看到的现象是 .要证明Na2SO3具有氧化性,应选用的试剂有 ,反应的离子方程式是 .
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 .
查看习题详情和答案>>
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应