摘要:20.如图:横轴表示溶液的pH.纵轴表示Zn2+离子或[Zn(OH)4]2-离子 物质的量浓度的对数.回答下列问题. (1)往ZnCl2溶液中加入过量的氢氧化钠溶液.反应的离子方程式可表示 . (2)从图中数据计算可得Zn(OH)2溶度积(Ksp)= . (3)某废液中含Zn2+离子.为提取Zn2+离子可以控制溶液的pH的范围是 . (4)往1L1.00mol·L-1ZnCl2溶液中加入NaOH固体至pH=6.需NaOH= mol(精确到小数点后2位.忽略溶液体积变化).
网址:http://m.1010jiajiao.com/timu3_id_400324[举报]
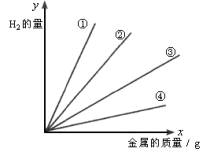
Mg、Zn、Al、Fe四种金属单质分别与足量的稀H2SO4作用放出H2的量如图,x轴表示金属的质量(g),y表示H2的量,则曲线①②③④所表示的金属依次是( )
A.Al、Mg、Fe、Zn B.Fe、Zn、Mg、Al
C.Mg、Al、Zn、Fe D.Zn、Fe、Mg、Al
查看习题详情和答案>>
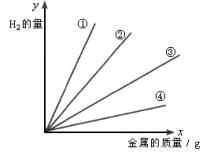
Mg、Zn、Al、Fe四种金属单质分别与足量的稀H2SO4作用放出H2的量如图,x轴表示金属的质量(g),y表示H2的量,则曲线①②③④所表示的金属依次是( )
A.Al、Mg、Fe、Zn B.Fe、Zn、Mg、Al
C.Mg、Al、Zn、Fe D.Zn、Fe、Mg、Al
查看习题详情和答案>>
(1)如图1,横坐标为溶液的pH,纵标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全).试回答下列问题:

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是 ,最小的是 .
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是 ,曲线Ⅱ对应的实验改变的条件是 .
③根据该反应特点,此反应自发进行的条件是 (填“高温”、“低温”或“任何温度”).
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
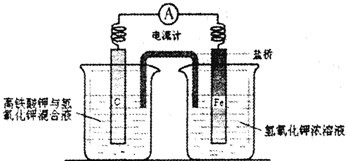
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是 .
②若该电池属于二次电池,则充电时阴极反应的电极反应式为 .
查看习题详情和答案>>

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:

已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为
 如图所示为电解质溶液的PH随外界条件T变化的图象,下列的叙述不正确的是( )
如图所示为电解质溶液的PH随外界条件T变化的图象,下列的叙述不正确的是( )