摘要:9.T℃时.反应物生成物均为气体的某反应.反应过程中浓度C的变化如图甲所示,若保持其他条件不变时.温度分别为T1.T2时.X的体积分数.温度与时间关系如图乙所示.则下列结论正确的是 ( ) A.在t1时间内.用x表示i该反应的平均速率为0.6mol/L·min B.在(t1+10)min时.保持其他条件不变.增大压强平衡向逆反应方向移动 C.T℃时.在相同容器内0由0.1mol/L X.0.3mol/LY.0.4mol/L Z进行反应.平衡时Z的浓度仍为0.4mol/L D.其他条件不变.温度升高时.正逆反应速率都加快.Y的转化率也加大
网址:http://m.1010jiajiao.com/timu3_id_400112[举报]
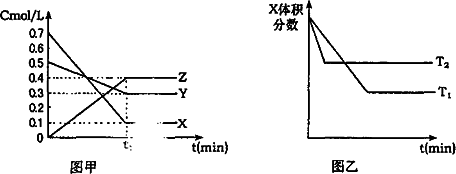
T℃时,反应物生成物均为气体的某反应,反应过程中浓度C的变化如图甲所示;若保持其他条件不变时,温度分别为T1,T2时,X的体积分数、温度与时间关系如图乙所示.则下列结论正确的是( )


| A、在t1时间内,用X表示该反应的平均速率为0.6mol/L?min | B、在(t1+10)min时,保持其他条件不变,增大压强平衡向逆反应方向移动 | C、T℃时,在相同容器内若由0.1mol/LX,0.3mol/LY,0.4mol/LZ进行反应,平衡时Z的浓度仍为0.4mol/L | D、其他条件不变,温度升高时,正逆反应速率都加快,Y的转化率也加大 |
|
T℃时,反应物生成物均为气体的某反应,反应过程中浓度C的变化如图甲所示;若保持其他条件不变时,温度分别为T1,T2时,X的体积分数、温度与时间关系如图乙所示.则下列结论正确的是
| |
| [ ] | |
A. |
在t1时间内,用x表示i该反应的平均速率为0.6 mol/L·min |
B. |
在(t1+10)min时,保持其他条件不变,增大压强平衡向逆反应方向移动 |
C. |
T℃时,在相同容器内0由0.1 mol/L X,0.3 mol/L Y,0.4 mol/L Z进行反应,平衡时Z的浓度仍为0.4 mol/L |
D. |
其他条件不变,温度升高时,正逆反应速率都加快,Y的转化率也加大 |
|
T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如下图(Ⅰ)所示.若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如下图(Ⅱ)所示,则下列结论正确的是
| |
| [ ] | |
A. |
在t1时间内用B表示该反应的平均速率为:0.6 mol·L-1·min-1 |
B. |
在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
C. |
T℃时,在相同容器中,若由0.1 mol·L-1 A、0.3 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1 |
D. |
在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大 |
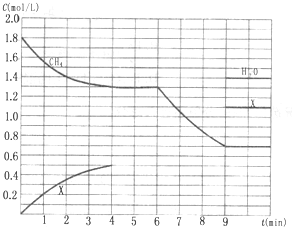 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
(1)CH4的燃烧热△H
<
<
△H1.(填“>”、“<”或“=”).(2)在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII
<
<
EIII(填“>”、“<”或“=”).(3)在1L固定容积密闭容器中投入1.8mol CH4和3.6mol H2O(g),若只发生反应Ⅳ,测得CH4、H2O(g)及某一生成物的物质的量浓度(c)随反应时间(t)的变化如图所示[第9min前H2O(g)的物质的量浓度及第4min~9min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑改变一个条件).
①0~4min内,H2的平均反应速率υ(H2)=
0.5
0.5
mol?(L?min)-1;②反应在5min时的平衡常数K=
0.91
0.91
;③第6min时改变的条件是
升高温度
升高温度
;判断理由是第6min~9min时的反应速率比0~4min时的大,且平衡向正反应方向移动,说明第6min改变的条件为升高温度或增加水蒸气的量,再根据第9min平衡时甲烷浓度为0.7mol/L,水蒸气浓度为1.4mol/L,说明甲烷消耗1.1mol,水蒸气消耗2.2mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度
第6min~9min时的反应速率比0~4min时的大,且平衡向正反应方向移动,说明第6min改变的条件为升高温度或增加水蒸气的量,再根据第9min平衡时甲烷浓度为0.7mol/L,水蒸气浓度为1.4mol/L,说明甲烷消耗1.1mol,水蒸气消耗2.2mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度
;④比较第5min时的平衡常数K5min与第10min时平衡常数K10min的大小:K5min
<
<
K10min (填“>”、“=”或“<”),原因是正反应为吸热反应,升高温度平衡常数增大
正反应为吸热反应,升高温度平衡常数增大
.
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: 2Z
2Z