网址:http://m.1010jiajiao.com/timu3_id_399905[举报]
 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.Ⅰ.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是
Ⅱ.铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.请填写下列空白:
(1)配制实验用的溶液.要配制500mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取
(2)把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的离子方程式:
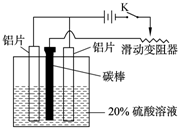
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:阳极:
Ⅰ.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是______(填化学式).
Ⅱ.铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.请填写下列空白:
(1)配制实验用的溶液.要配制500mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g NaOH固体.
(2)把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的离子方程式:______.
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:阳极:______;阴极:______.
Ⅰ.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是______(填化学式).
Ⅱ.铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.请填写下列空白:
(1)配制实验用的溶液.要配制500mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g NaOH固体.
(2)把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的离子方程式:______.
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:阳极:______;阴极:______.
 查看习题详情和答案>>
查看习题详情和答案>>
(08威海市模拟)(8分)钢材厂家在生成钢材之后对其表面进行处理,形成一层致密的氧化物保护层;而使用厂家在对钢材进行加工使用前往往要除去钢材表面的氧化物,其中一种常见的方法是利用硫酸与钢材反应,此方法除去氧气的原理不是因为氧化物与酸反应,而是由于氧化物里面的金属铁与酸反应生成了氢气,使氧化物与金属分离脱落。但是在实际生产中工人师傅有几个问题请你帮助解决一下:
(1)下列哪种操作可以加快除去氧化物的速率 (填编号)
A.用浓硫酸 B.用中等浓度的硫酸
C.适当的提高温度 D.加少许铜屑
(2)反应的过程中溶液中 离子减少, 离子增加
(3)工业上在除氧化物过程中铁除了与硫酸反应外还与另一种离子反应,请写出离子方程式_______。
(4)为了减少废物,请你考虑可以从反应后的溶液中提取 物质。
提取分离时 → →趁热过滤
查看习题详情和答案>>
(14分)某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用