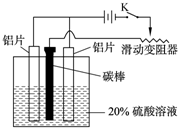
题目内容
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.Ⅰ.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是______(填化学式).
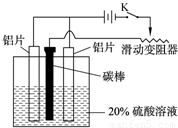
Ⅱ.铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.请填写下列空白:
(1)配制实验用的溶液.要配制500mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g NaOH固体.
(2)把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的离子方程式:______.
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:阳极:______;阴极:______.
【答案】分析:Ⅰ、化合价降低的元素所在的反应物是氧化剂;
Ⅱ、(1)根据公式m=ρvw%来计算溶质的质量;
(2)氧化铝是两性氧化物,能溶于强碱溶液;
(3)电解池的阳极材料是活泼电极时,则该电极反应是金属本身失电子的过程,阴极发生阳离子的得电子过程.
解答:解:Ⅰ.反应②中,NaNO2中氮元素的化合价由+3价降为-3价,化合价降低的元素所在的反应物是氧化剂,
故答案为:NaNO2;
Ⅱ、(1)NaOH的质量m=ρvw%=1.2g?cm-3×500mL×16%=96g,故答案为:96;
(2)氧化铝是两性氧化物,能溶于强碱溶液,离子方程式为:Al2O3+2OH-═2AlO-2+H2O,故答案为:Al2O3+2OH-═2AlO-2+H2O;
(3)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-→Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-→3H2,故答案为:2Al+3H2O-6e-→Al2O3+6H+;6H++6e-→3H2↑.
点评:本题考查了氧化还原反应中的有关概念、电化学知识以及氧化铝的性质等方面内容,综合性强,难度不大.
Ⅱ、(1)根据公式m=ρvw%来计算溶质的质量;
(2)氧化铝是两性氧化物,能溶于强碱溶液;
(3)电解池的阳极材料是活泼电极时,则该电极反应是金属本身失电子的过程,阴极发生阳离子的得电子过程.
解答:解:Ⅰ.反应②中,NaNO2中氮元素的化合价由+3价降为-3价,化合价降低的元素所在的反应物是氧化剂,
故答案为:NaNO2;
Ⅱ、(1)NaOH的质量m=ρvw%=1.2g?cm-3×500mL×16%=96g,故答案为:96;
(2)氧化铝是两性氧化物,能溶于强碱溶液,离子方程式为:Al2O3+2OH-═2AlO-2+H2O,故答案为:Al2O3+2OH-═2AlO-2+H2O;
(3)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-→Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-→3H2,故答案为:2Al+3H2O-6e-→Al2O3+6H+;6H++6e-→3H2↑.
点评:本题考查了氧化还原反应中的有关概念、电化学知识以及氧化铝的性质等方面内容,综合性强,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术. 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.