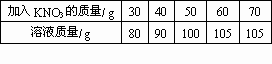网址:http://m.1010jiajiao.com/timu3_id_39988[举报]
|
一定温度下,在质量都是50 g的五份水中分别加入30 g、40 g、50 g、60 g、70 gKNO3固体,充分搅拌后,滤去未溶解的KNO3.加入的KNO3质量与相应所得溶液的质量数据见下表:则该温度下KNO3的溶解度是
| |
| [ ] | |
A. |
60克 |
B. |
80克 |
C. |
100克 |
D. |
110克 |
| 加入KNO3的质量/g | 30 | 40 | 50 | 60 | 70 |
| 溶液质量/g | 80 | 90 | 100 | 105 | 105 |
| A、60克 | B、80克 |
| C、100克 | D、110克 |
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用.根据题意完成下列计算:
1.由硫与限量氯气在50~60℃反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B.A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71.计算确定这两种氯化物的分子式分别为________.
若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为________.
2.硫的卤化物或卤氧化物都有强水解性,可以作脱水剂.SF4吸收V mL液态水(4℃),完全反应,得到3.2 g SO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为________mL.
3.S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物.一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:
6S2Cl2+16NH3→S4N4+S8+12NH4Cl;
24SCl2+64NH3→4S4N4+S8+48NH4Cl.
S2Cl2、SCl2的混合液体52.86 g溶于足量的CS2中,再通入35.84 L氨气(标准状况)完全氨解,产生14.080 g硫单质.剩余氨气用40 g水完全吸收形成氨水(密度为0.923 g/mL).
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为________.
②所得氨水的物质的量浓度为________(保留1位小数).
4.S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26 K的低温下,可转变为超导体(superconductor).(SN)x的结构式为:

已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物.测得缩合产物中二百聚物的质量分数为0.50.
计算:①缩合产物中各缩合物的物质的量.
②若Ag的实际使用量为8.64 kg,求Ag的循环使用次数.