网址:http://m.1010jiajiao.com/timu3_id_399766[举报]
(15分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | NO | H2O |
| ② | FeCl3溶液、双氧水 |
| H2O |
| ③ | Zn、稀H2SO4 | H2 | H2O |
| ④ | NaOH固体、浓氨水 | NH3 |
|
| ⑤ | Na2CO3固体、稀H2SO4 | CO2 |
|
| ⑥ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
① ,
② ,③视线与凹液面最低处相平。
(2)实验②收集的气体是 。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是 。
(4)实验④、⑤中,量气管中的液体分别是 、 。
A.稀H2SO4 B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)在25℃,101kPa条件下,取![]() =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 20.0mL | 382.2mL |
| 2 | 1.0g | 20.0mL | 360.0mL |
| 3 | 1.0g | 20.0mL | 377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
查看习题详情和答案>>
(8分)(2010·石家庄质量检测)在一密闭容器中发生反应N2+3H2 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: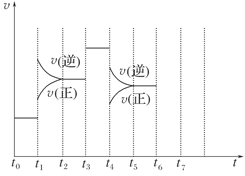
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为________。
(15分)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)

|
实验 |
药品 |
制取气体 |
量气管中的液体 |
|
① |
Cu、稀HNO3 |
NO |
H2O |
|
② |
FeCl3溶液、双氧水 |
|
H2O |
|
③ |
Zn、稀H2SO4 |
H2 |
H2O |
|
④ |
NaOH固体、浓氨水 |
NH3 |
|
|
⑤ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
|
⑥ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)本实验应对量气管多次读数,读数时应注意
① ,
② ,③视线与凹液面最低处相平。
(2)实验②收集的气体是 。
(3)若向实验③反应体系中加少量CuSO4溶液,反应速率加快,原因是 。
(4)实验④、⑤中,量气管中的液体分别是 、 。
A.稀H2SO4 B.CCl4 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)在25℃,101kPa条件下,取 =24.0L/mol。实验⑥数据如下:
=24.0L/mol。实验⑥数据如下:
|
编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
|
1 |
1.0g |
20.0mL |
382.2mL |
|
2 |
1.0g |
20.0mL |
360.0mL |
|
3 |
1.0g |
20.0mL |
377.8mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
查看习题详情和答案>>
(本题共12分)在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
|
t c |
初始 |
2min |
4min |
6min |
8min |
|
c(A)( mol·L -1) |
2.50 |
2.20 |
2.00 |
2.00 |
2.20 |
|
c(B)( mol·L -1) |
1.56 |
2.16 |
2.56 |
2.56 |
2.16 |
|
c(C)( mol·L -1) |
0.39 |
0.54 |
0.64 |
0.64 |
1.54 |
请填空:
(1)前2mim内,v(B)= 。
(2) 到2mim末A 的转化率为 。
(3)该反应的化学方程式为 。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为 (填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为 mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则 是原来的2倍。
a. A的转化率 b. B的平衡浓度 表 c.达到平衡的时间 d.平衡时气体的密度
查看习题详情和答案>>
(09广东卷).(分) 甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
查看习题详情和答案>>