网址:http://m.1010jiajiao.com/timu3_id_3996958[举报]
(17分)具有还原性的无水草酸是无色无臭的透明结晶或白色粉末。草酸在浓硫酸并加热条件下容易脱去水分,分解为二氧化碳和一氧化碳。
(1)草酸(H2C2O4)分解的化学方程式 为: ,
下列装置中,可用于草酸分解制取气体的是 。(填字母)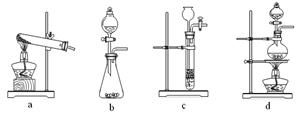
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),实验装置如下图所示,请回答: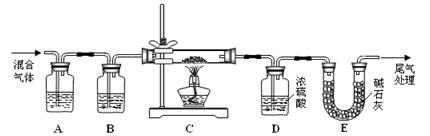
① 为得 到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是 、 。
② 在点燃酒精灯之前应进行的操作是:(a) ;(b)通入混合气体一段时间。
③ 准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃 管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = (假定Fe和H2O 不发生反应,实验过程中每步均完全吸收或反应)。
④ 在本实验中,下列情况会使测定结果n偏大的是 (填字母)。
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3·nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
① 请完成以下实验设计表(表中不要留空格):
(每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂 的用量可选择0.5g、0g)
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | C/mol·l-1:学科网] | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | | 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化剂对反应速率的影响 | | | | 0.1 |
通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案 。 查看习题详情和答案>>
(15分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
0.100 |
0 |
0 |
|
10 |
0.058 |
0.021 |
0.021 |
|
20 |
0.040 |
0.030 |
0.030 |
|
30 |
0.040 |
0.030 |
0.030 |
|
40 |
0.032 |
0.034 |
0.017 |
|
50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
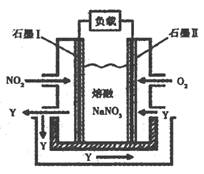
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
查看习题详情和答案>>
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式___________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
已知: ,则实验选择的最简单的装置接口连接顺序为________;
,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H="-393.5" kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
(12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g) △H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,经过一段时间后反应重新达到平衡,则改变的条件可能是
③若30min后升高温度至T2℃,达到平衡时,容器中的NO、N2、CO2的浓度之比为5:3:3,则该反应的△H (填“>”、“<”或“=”)0
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H20(g) △H=-574kJ.mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ.mol-1
③H2O(g)=H2O(l) △H=-44.0kJ.mol-1
写出CH4和NO2反应生成N2(g) 、CO2(g)和 H2O(l)的热化学方程式:
(3)选择性催化还原(SCR)脱硝技术是目前应用最广、最有效的烟气脱硝技术之一。该技术涉及以下反应:4NO(g)+4NH3(g)+ O2(g)=在4N2(g)+ 6H2O(g),在恒容的密闭容器中,下列有关说法中正确的是 (填字母)
A.其他条件不变,使用高效催化剂,烟气中NO的转化率增大
B.单位时间内消耗NH3和NO的物质的量之比为1:1时,反应达到平衡
C.其他条件不变时升高温度,反应的平衡常数减小
D.反应达到平衡后,再向容器中充入等量的反应物,再次达到平衡时,NO的转化率减小
(4)以NO2 、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,该电极的电极反应可表示为
 查看习题详情和答案>>
查看习题详情和答案>>
(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应N2(g)+3H2(g)
2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)
。
(1)合成氨反应N2(g)+3H2(g)
2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)
。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
 2 N2O5(g)
4NO2(g)+O2(g) △H>0
2 N2O5(g)
4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
|
t/s |
0 |
500[来源:学|科|网] |
1000 |
|
C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填
“>”“<”“=” )
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼 。说明原因 。
查看习题详情和答案>>