摘要:15.可用右上侧示意图表示的是 反应 纵坐标 甲 乙 A 等质量钾.钠分别与水反应 H2质量 钠 钾 B 相同质量SO3.在同一容器中 SO3的转化率 400゜C 500゜C C B的浓度 活性高的催化剂 活性一般的催化剂 D 1molN2与3molH2,在相同温度下 NH3的物质的量 10个大气压 2个大气压
网址:http://m.1010jiajiao.com/timu3_id_399627[举报]
将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程中,溶液的c(H+)与Cl2用量关系可用下列哪个示意图表示(设溶液的体积不变)

(1)A,B,C,D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C、形成10电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).A22-与C22+互为等电子体,C22+的电子式
②N的沸点比其同族相邻氢化物沸点高的主要原因是 .W分子的空间构型的名称是
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1.
①F元素基态原子电子排布式为
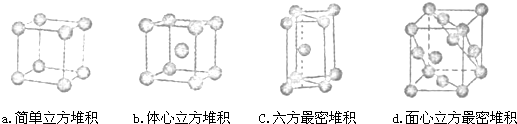
②E元素单质的晶体堆积模型为 (填字母)
③向G的硫酸盐溶液中通入过量N气体,可生成 [G(N)4]2+不考虑空间构型,[G(N)4]2+的结构可用示意图表示为 (用元素符号表示).
查看习题详情和答案>>
①A、B、C的第一电离能由小到大的顺序为
②N的沸点比其同族相邻氢化物沸点高的主要原因是
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1.
①F元素基态原子电子排布式为
②E元素单质的晶体堆积模型为

③向G的硫酸盐溶液中通入过量N气体,可生成 [G(N)4]2+不考虑空间构型,[G(N)4]2+的结构可用示意图表示为
配制500mL 0.5mol/L的NaOH溶液.操作步骤如下:
①用
②静置,冷却至室温.
③请回答下列问题
(1)填写操作步骤①中的两处空白.
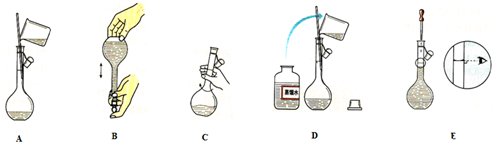
(2)③中的实验步骤可用右侧示意图表示,其先后顺序是(填字母):
A→
(3)容量瓶是该实验的关键性仪器之一.下列说法正确的是(填字母)
a.容量瓶在使用前必须验漏
b.用蒸馏水洗容量瓶后必须要将其烘干
c.在容量瓶上通常标有温度、容量和刻度线
d.定容时仰视容量瓶刻度线会使所配溶液浓度偏低.
查看习题详情和答案>>

①用
托盘天平
托盘天平
(填仪器名称)称量10.0
10.0
g NaOH固体放入小烧杯中,加适量蒸馏水溶解.②静置,冷却至室温.
③请回答下列问题
(1)填写操作步骤①中的两处空白.
(2)③中的实验步骤可用右侧示意图表示,其先后顺序是(填字母):
A→
C
C
→D
D
→E→B
B
.(3)容量瓶是该实验的关键性仪器之一.下列说法正确的是(填字母)
acd
acd
.a.容量瓶在使用前必须验漏
b.用蒸馏水洗容量瓶后必须要将其烘干
c.在容量瓶上通常标有温度、容量和刻度线
d.定容时仰视容量瓶刻度线会使所配溶液浓度偏低.
 《物质结构与性质》
《物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是
A
A
(填字母).A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
O=C=S
O=C=S
.光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为平面三角形
平面三角形
(用文字描述).(3)Cu 2+基态的电子排布式为
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为sp3
sp3
,不考虑空间构型,其内界结构可用示意图表示为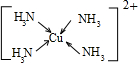

请回答下列问题:
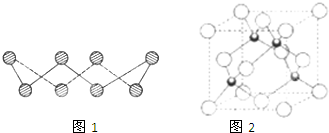
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
(3)34号元素的价层电子的电子排布图为
(4)气态SO2分子的立体构型为
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为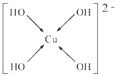
 .
.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
查看习题详情和答案>>

(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是
sp3
sp3
.(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为
Al>Mg
Al>Mg
;O与F电负性大到小的顺序为F>O
F>O
.(用<或=或>表示)(3)34号元素的价层电子的电子排布图为
1s22s22p63s23p63d104s24p4
1s22s22p63s23p63d104s24p4
,在周期表位于第四周期第ⅥA族
第四周期第ⅥA族
区;Mn2+基态的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(4)气态SO2分子的立体构型为
V形
V形
;SO32-离子的立体构型为三角锥型
三角锥型
(均用文字描述)(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离
;②H2SeO4比H2SeO3酸性强的原因:
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+
;(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为


(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
CuCl
CuCl
.