网址:http://m.1010jiajiao.com/timu3_id_399213[举报]
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
查看习题详情和答案>>
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
(1)离子B-的结构示意图为




(2)A、E、F形成的简单离子的半径由大到小的顺序为
(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W?8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为
(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一.有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3.该电池的负极反应式为
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
| ||
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)
 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.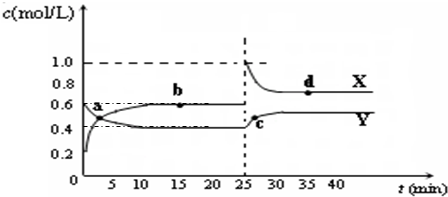
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是