网址:http://m.1010jiajiao.com/timu3_id_399026[举报]
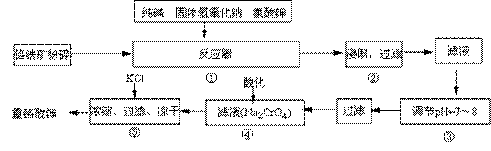
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O,
12Na2CrO4+3Fe2O3+7KCl+12H2O,

试回答下列问题:
⑴ 反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
⑵ NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
⑶ 作③的目的是什么,用简要的文字说明: 。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
② 断达到滴定终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
查看习题详情和答案>>
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3
+7KCl+12H2O,
12Na2CrO4+3Fe2O3
+7KCl+12H2O,
试回答下列问题:
⑴ 反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
⑵ NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
⑶ 作③的目的是什么,用简要的文字说明: 。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
② 断达到滴定终点的现象是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
查看习题详情和答案>>
| ||
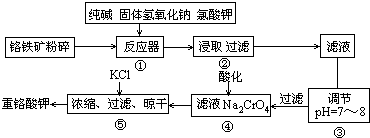
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式
(4)用简要的文字说明操作⑤加入KCl的原因
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与腆量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)
6FeO?Cr2O3+24NaOH+7KClO3
| ||
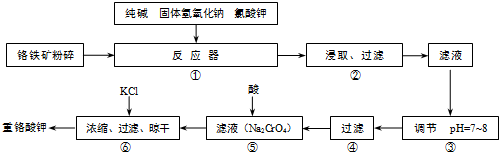
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:
(3)步骤③中测定pH值的操作为:
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
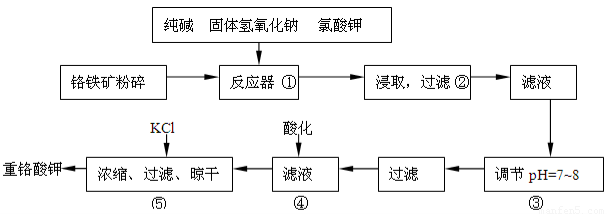
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2 Δ Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOH Δ 2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3 参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶???????? B.萃取分液???????? C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
查看习题详情和答案>>