网址:http://m.1010jiajiao.com/timu3_id_3988805[举报]
| 熔点 ℃ |
沸点 ℃ |
液态时 密度 g/cm3 |
18℃时在水中的溶解度 mL/L |
乙醚、丙酮 或苯中的 溶解性 |
乙醇 中的 溶解性 |
| -97.73 | -24.2 | 0.9159 | 280 | 互溶 | 能溶 |

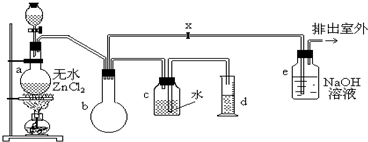
制备装置的分液漏斗中盛有甲醇,烧瓶中盛有浓盐酸.
请填写下列空白:
(1)制备一氯甲烷的化学方程式是
(2)装置e中可能发生反应的化学方程式是
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃的燃烧现象有明显区别,且生成物中有HCl).CH3Cl燃烧的化学方程式是
(4)装置b的作用是
| 熔点 ℃ |
沸点 ℃ |
液态时 密度 g/cm3 |
18℃时在水中的溶解度 mL/L |
乙醚、丙酮 或苯中的 溶解性 |
乙醇 中的 溶解性 |
| -97.73 | -24.2 | 0.9159 | 280 | 互溶 | 能溶 |
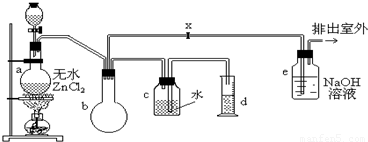
制备装置的分液漏斗中盛有甲醇,烧瓶中盛有浓盐酸.
请填写下列空白:
(1)制备一氯甲烷的化学方程式是______;该反应属于______反应.
(2)装置e中可能发生反应的化学方程式是______.
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃的燃烧现象有明显区别,且生成物中有HCl).CH3Cl燃烧的化学方程式是______.
(4)装置b的作用是______.某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的量比理论计算的量多(装置的气密性没有问题),其原因是______.实验结束后,d中收集到的液体中含有______.
| 熔点 ℃ | 沸点 ℃ | 液态时 密度 g/cm3 | 18℃时在水中的溶解度 mL/L | 乙醚、丙酮 或苯中的 溶解性 | 乙醇 中的 溶解性 |
| -97.73 | -24.2 | 0.9159 | 280 | 互溶 | 能溶 |
制备装置的分液漏斗中盛有甲醇,烧瓶中盛有浓盐酸.
请填写下列空白:
(1)制备一氯甲烷的化学方程式是______;该反应属于______反应.
(2)装置e中可能发生反应的化学方程式是______.
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃的燃烧现象有明显区别,且生成物中有HCl).CH3Cl燃烧的化学方程式是______.
(4)装置b的作用是______.某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇和浓盐酸的量比理论计算的量多(装置的气密性没有问题),其原因是______.实验结束后,d中收集到的液体中含有______.
查看习题详情和答案>>
在常温下,一氯甲烷是无色气体,密度为0.9159g/cm3,熔点-97.73℃,沸点为-24.2℃;18℃时它在水中的溶解度为280mL/L水,它与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室可用图所示装置制造一氯甲烷。

制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,试填写下列空白.
(1)制备一氯甲烷的化学方程式为 ;其反应类型是
(2)装置b的作用是_ ___
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其他烃燃烧现象有明显区别),CH3Cl燃烧的化学方程式为__ __
(4)实验中实际按甲醇和浓盐酸1∶2(物质的量之比)进行反应的理由是___ _
(5)某学生在关闭活塞X的情况下做此实验时,发现收集到一定体积的气体产物所消耗的甲醇—浓盐酸的混合液的量比正常情况下多(装置的气密性没有问题),其原因是____
(6)实验结束时,d中收集到的液体中含有_
查看习题详情和答案>>肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水.氢气是一种清洁能源,液氢和肼均可用作火箭燃料.
Ⅰ氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
(1)氢气作为新能源的优点________.(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________.
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示.图中A、B表示的物质依次是________、________.

Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,负极的电极反应式是________.
(5)下图是一个电化学装置示意图.用肼一空气燃料电池做此装置的电源.

①如果A是铂电极,B是石墨电极,C是硫酸-硫酸铵,阴极的电极反应式是________.
②利用该装置可制得少量过氧化氢:在阳极上SO42-被氧化成S2O82-(过二硫酸根离子),S2O82-与H2O反应生成H2O2,S2O82-+2H2O=2SO42-+H2O2+2H+.若要制取2 molH2O2,该燃料电池理论上需消耗________molN2H4.
(6)由A、B、C、D四种金属按下表中装置进行实验.
实验装置与现象

根据实验现象回答下列问题:
①装置丙中溶液的PH________.(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是________.