摘要:22. 2 g Cu2 S和CuS的混合物在酸性溶液中用400 mL 0.075 mol/L KMnO4溶液处理.发生反应如下: 8MnO+5Cu2 S+44H====10Cu+5SO2+8Mn+22H2O 6MnO+5CuS+28H====5Cu+5SO2+6Mn+14H2O 反应后煮沸溶液.赶尽SO2.剩余的KMnO4恰好与350 mL 0.1 mol/L(NH4)2 Fe(SO4)2溶液完全反应.
网址:http://m.1010jiajiao.com/timu3_id_398790[举报]
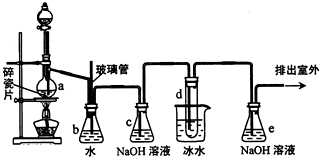 1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.
1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.已知:CH3CH2OH
| 浓硫酸 |
| 170℃ |
CH3CH2OH
| 浓硫酸 |
| 140℃ |
相关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g.cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(2)安全瓶b在实验中有多重作用.其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象;如果实验中导管d堵塞,你认为可能的原因是;安全瓶b还可以起到的作用是
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为
(6)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出.(此温度下,铵盐不分解).该气体干燥后用足量的浓硫酸完全吸收.浓硫酸增重的质量与加入NaOH溶液的体积的关系如右图.分析该图象,并回答下列问题:
(1)写出ab段涉及的离子方程式:
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(2)c点对应的数值是
4.25
4.25
;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为9:2
9:2
.乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收.测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
(3)①分析实验数据可知,实验编号为
I
I
的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体;m的值为2.04
2.04
.②计算样品B中氮元素的质量分数.(用小数表示,保留两位小数)
(4)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系.假设样品的质量为x(g),浓硫酸增重的质量为y(g).求:当x在不同范围时y与x的函数关系.
 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此温度下该反应的平衡常数K=
0.0073
0.0073
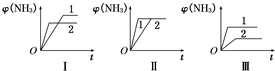
.(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
D
D
(填字母).A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:
C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ?mol-1,△S=+133.7J?K-1?mol-1
该反应在常温下能否自发进行?
不能
不能
(填“能”或“不能”).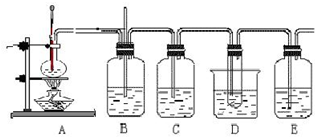 乙烯与液溴作用制取1,2-二溴乙烷的装置如下.(D中试管里所装物质为液溴)
乙烯与液溴作用制取1,2-二溴乙烷的装置如下.(D中试管里所装物质为液溴)1,2-二溴乙烷的主要物理性质见下表:
| 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 9.79 | 131.4 | 2.18 | 难溶于水,易溶于醇、醚等 |
冷却液溴
冷却液溴
.(2)C和E中,所盛都是NaOH溶液,它们的作用分别是:C
吸收乙烯中混有的SO2、CO2
吸收乙烯中混有的SO2、CO2
;E吸收逸出的溴蒸气,防止污染空气
吸收逸出的溴蒸气,防止污染空气
.(3)写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式
CH3CH2OH
CH2=CH2↑+H2O
| 浓硫酸 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
;| 浓硫酸 |
| 170℃ |
CH2=CH2+Br-Br→CH2Br-CH2Br
CH2=CH2+Br-Br→CH2Br-CH2Br
.合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此温度下该反应的平衡常数K=
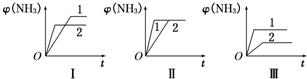
(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气
具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:
a、CH3CH2OH(g)+H2O(g)?4H2(g)+2CO(g)△H=+255.58kJ/mol
b、CH3CH2OH(g)+1/2O2(g)?3H2(g)+2CO(g)△H=+13.76kJ/mol
下列说法错误的是:
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.降低温度,可提高b路线中乙醇的转化率.
查看习题详情和答案>>

(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00mol?L-1,c(N2)=3.00mol?L-1,c(NH3)=4.00mol?L-1,此温度下该反应的平衡常数K=
7.32×10-3
7.32×10-3
.(2)在三个相同容器中各充入1mol N2和3mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示.下列说法中正确的是
D
D
(填字母,下同).A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气
具有良好的应用前景.已知通过乙醇制取氢气有如下两条路线:
a、CH3CH2OH(g)+H2O(g)?4H2(g)+2CO(g)△H=+255.58kJ/mol
b、CH3CH2OH(g)+1/2O2(g)?3H2(g)+2CO(g)△H=+13.76kJ/mol
下列说法错误的是:
D
D
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.降低温度,可提高b路线中乙醇的转化率.